HOME > 基礎研究グループの活動 > iPS細胞・再生医療研究グループ
iPS細胞・再生医療研究グループ
新着情報
2023年3月
第22回日本再生医療学会にて吉田善紀がシンポジウム「心臓再生の現状と未来」・共催学術セミナー「心臓領域におけるiPS細胞を用いた再生医療・創薬研究update」にて発表しました。また舟越俊介が口頭発表を行いました。
2023年3月
第87回日本循環器学会学術集会にて吉田善紀がプレナリーセッション「循環器疾患における再生医療の現状と将来」で発表しました。また舟越俊介、藤原侑哉、畑玲央が口頭発表を行いました。
2022年11月
Yu Tian, Antonio Lucena-Cacaceらの論文"Immunosuppressants Tacrolimus and Sirolimus revert the cardiac antifibrotic properties of p38-MAPK inhibition in 3D-multicellular human iPSC-heart organoids."がFrontiers in Cell and Developmental Biology誌に掲載されました。iPS細胞研究所のホームページに掲載されています。
2022年11月
シカゴで行われたAHA scientific sessions(アメリカ心臓協会)にて小圷美聡がポスター発表を行いました。
2022年7月
第30回 CiRAカフェ(オンライン)で「iPS細胞を用いた心臓再生医療の現状と今後の展開」についてお話ししました。こちらからご視聴いただけます。
2022年6月
辻坂勇太、羽溪健らの論文" Purification of human iPSC-derived cells at large scale using microRNA switch and magnetic-activated cell sorting"がStem Cell Reports誌に掲載されました.iPS細胞研究所のホームページに掲載されています。
2022年3月
第21回日本再生医療学会にて吉田善紀がシンポジウム「iPS細胞を用いた心臓再生医療の臨床に向けた現状と課題」にて発表しました。またJunghofが口頭発表を行いました。
2022年3月
第86回日本循環器学会学術集会にて吉田善紀がシンポジウム「幹細胞・遺伝子治療・心臓再生の最前線」とSpecial session「New developments of iPS cell research」で発表しました。
2022年2月
Julia Junghof, Antonio Lucena-Cacaceらの論文"CDH18 is a fetal epicardial biomarker regulating differentiation towards vascular smooth muscle cells"がnpj Regenerative Medicine誌に掲載されました。iPS細胞研究所のホームページに掲載されています。
2021年12月
森本有紀、蝶名林和久らの論文"Azacitidine is a potential therapeutic drug for pyridoxine-refractory female X-linked sideroblastic anemia"がBlood Advances誌に掲載されました。iPS細胞研究所のホームページに掲載されています。
2021年10月
舟越俊介らのレビュー論文"Recent progress of iPSC technology in cardiac diseases"がArchives of Toxicology誌に掲載されました。
2021年7月
Springer Natureが発行するプロトコールフォーマットのブックシリーズであるMethods in Molecular Biologyシリーズから吉田善紀が編集した『Pluripotent Stem Cell-Derived Cardiomyocytes』が出版されました。
2021年7月
大久保周子らの論文" Expression dynamics of HAND1/2 in in vitro human cardiomyocyte differentiation"がStem Cell Reports誌に掲載されました。iPS細胞研究所のホームページに掲載されています。
2021年6月
三木健嗣、小圷美聡らの論文" ERRγ enhances cardiac maturation with T-tubule formation in human iPSC-derived cardiomyocytes"がNature Communications誌に掲載されました。iPS細胞研究所のホームページに掲載されています。この成果は京都新聞、時事通信、日刊工業新聞、NHK、関西テレビなどで報道されました。
2020年8月
ESC Congress 2020 (欧州心臓病学会) (アムステルダム)にて小圷美聡、藤原侑哉がポスター発表を行いました。
2019年11月
フィラデルフィアで行われたAHA scientific sessions(アメリカ心臓協会)にて小圷美聡、羽溪健が口頭発表、笠本学がポスター発表を行いました。
2019年3月
高木正らの論文" Optical recording of action potentials in human induced pluripotent stem cell-derived cardiac single cells and monolayers generated from long QT syndrome type 1 patient"がStem Cells International誌に掲載されました。
2018年11月
シカゴで行われたAHA scientific sessions(アメリカ心臓協会)にて羽溪健、笠本学がポスター発表を行いました。
2018年11月
羽溪健らの論文" Nano-structural analysis of engrafted human induced pluripotent stem cell-derived cardiomyocytes in mouse hearts using a genetic-probe APEX2"がBiochemical and Biophysical Research Communications誌に掲載されました。iPS細胞研究所のホームページに掲載されています。
2017年11月
アナハイムで行われたAHA scientific sessions(アメリカ心臓協会)にて吉田が口頭発表(Frontiers in Science)、羽溪健がポスター発表を行いました。
2017年6月
吉田善紀らの論文"Induced Pluripotent Stem Cells Ten Years Later: For Cardiac Applications"がCirculation Research誌に掲載されました。
2016年11月
ニューオーリンズで行われたAHA scientific sessions(アメリカ心臓協会)にて吉田が口頭発表(Frontiers in Science)、羽溪健がポスター発表を行いました。
2016年7月
西澤正俊らの論文" Epigenetic Variation between Human Induced Pluripotent Stem Cell Lines Is an Indicator of Differentiation Capacity"がCell Stem Cell誌に掲載されました。京都大学のホームページに掲載されています。この成果は京都新聞(7月29日 27面)、日刊工業新聞(7月29日 21面)、毎日新聞(8月2日 23面)、読売新聞(8月1日夕刊 16面)に掲載されました。
2016年6月
サンフランシスコで行われたISSCR (国際幹細胞学会) Annual meetingにて大久保周子がポスター発表を行いました。
2016年1月
舟越俊介らの論文" Enhanced engraftment, proliferation, and therapeutic potential in heart using optimized human iPSC-derived cardiomyocytes" がScientific Reports誌に掲載されました。京都大学のホームページに掲載されています。この成果は京都新聞(1月9日 25面)、産経新聞(1月9日 25面)、日刊工業新聞(1月12日 15面)、日本経済新聞(1月9日 38面)、毎日新聞(1月14日 23面)および読売新聞(1月10日 35面)に掲載されました。
2015年11月
オーランド(アメリカ)にて行われたAHA scientific sessions(アメリカ心臓協会)にて羽渓健がポスター発表を行いました。
2015年6月
ストックホルムで行われたISSCR (国際幹細胞学会) Annual meetingにて西澤正俊、高木正、舟越俊介、三木健嗣、大久保周子がポスター発表を行いました。三木健嗣がTravel Awardを受賞しました。
2015年5月
三木健嗣、遠藤慧らの論文"Efficient Detection and Purification of Cell Populations Using Synthetic MicroRNA Switches"がCell Stem Cell誌に掲載されました。京都大学のホームページに掲載されています。またこの成果は新聞(5月22日 23面)、産経新聞(5月22日 26面)、中日新聞(5月22日 3面)、日刊工業新聞(5月22日 17面)、日本経済新聞(5月22日 42面)および毎日新聞(5月22日 6面)に掲載されました。
2015年4月
第79回日本循環器学会学術集会にて舟越俊介、三木健嗣の両名がYoung Investigator's Award (Basic research部門) 優秀賞を受賞しました。
2014年11月
シカゴ(アメリカ)にて行われたAHA scientific sessions(アメリカ心臓協会)にて舟越俊介が口述発表とポスター発表、三木健嗣がポスター発表を行いました。
当研究室の概要
私たちはES/iPS細胞由来の心筋細胞および血液細胞を用いた臨床応用(再生医療、創薬、疾患研究)を目標として、下記のテーマに取り組んでいます。
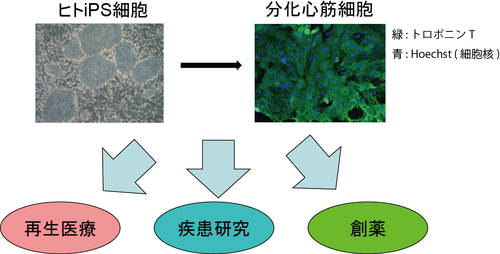
研究内容
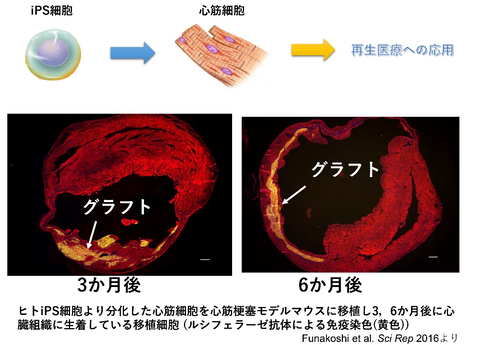
①心筋再生
現在の治療法では効果が期待できない患者に対する次世代の治療としてES/iPS細胞を用いた心筋再生治療の開発が期待されています。当研究室では心筋分化誘導法の開発、心筋再生治療に適したiPS細胞株の樹立・選別法の開発、心筋細胞の効率の良い移植法の開発の研究を行い、iPS細胞より作製した心筋細胞を用いて、治療効果の高い再生医療を開発することを目指して研究を行っています。
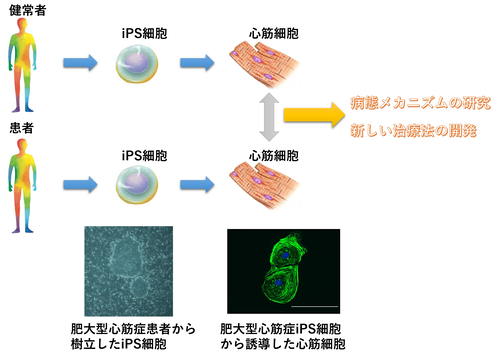
②疾患特異的iPS細胞研究
患者の細胞から樹立したiPS細胞から誘導した細胞を用いて試験管内で疾患を再現することにより、疾患のメカニズムや創薬研究が可能になりました。疾患特異的iPS細胞研究はヒトの心筋細胞を安定して誘導することが可能になったことや、CRISPR/Cas9などの技術により遺伝子を編集することが可能になってきたこともあり、今後医学研究においてますます重要な役割をもつと思います。当研究室では心疾患(心筋症など)の患者の細胞から樹立したiPS細胞を用いて、疾患のメカニズム解析や治療薬の開発を目指しています。
iPS細胞による肥大型心筋症の病態モデルでは、ハイスループットスクリーニングにより治療薬の候補化合物を同定し、新規治療開発に向けて研究を進めています。
また肥大型心筋症患者の実態調査のためのレジストリー研究を実施しています(PREVAIL-HCM研究)。
③心筋分化誘導法、成熟制御法の開発
ES/iPS細胞由来心筋細胞は創薬や薬剤の毒性検査においても注目されています。創薬や薬剤の毒性検査には成人心臓組織に近い成熟した心筋細胞のほうが適しています。また心筋細胞は心室筋、心房筋、ペースメーカー細胞などさまざまなサブタイプの細胞が存在します。再生医療や創薬、疾患研究のためには目的に応じたサブタイプ、成熟度の細胞を使用することが重要と考えます。当研究室では分化細胞の分化成熟を制御することにより、再生医療や創薬、疾患研究に適した細胞を効率よく作製する方法の開発を目指しています。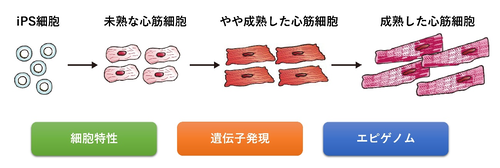
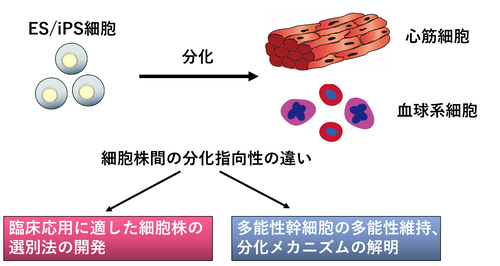
④ES/iPS細胞株の分化能を規定しているメカニズムの解明
ES/iPS細胞は分化誘導時に特定の細胞への分化しやすさ(分化指向性)は細胞株ごとに異なります。心筋細胞、血液細胞などの中胚葉系の細胞への分化誘導におけるES/iPS細胞のふるまいを細胞株間で比較解析することにより、ES/iPS細胞のふるまいを規定しているメカニズムの解明、多能性維持・分化のメカニズムの解明、さらにそれらの知見を用いて再生医療などの臨床応用に最適なiPS細胞株の樹立法、分化誘導法の開発を目指しています。
所属者
- 吉田 善紀(准教授)
- 舟越 俊介(特定助教)
- 蝶名林 和久(特定病院助教・血液内科)
- Antonio Lucena- Cacace(特命助教)
- 高木 正(研究員)
- 藤原 侑哉(研究員)
- 脇水 孝之(研究員)
- 笠本 学(研究員)
- 稲塚 歩佳(研究員)
- Martta Häkli (研究員)
- 中村 桃子(研究員)
- 辻坂 勇太(大学院生)
- 畑 玲央(大学院生)
- 田 雨(大学院生)
- 三好 悠太郎(大学院生)
- 谷 奏慧(大学院生)
- 柴田 翔 (大学院生)
- Alaa Fawzy (大学院生)
- 謝 佳軒 (大学院生)
- 山本 真衣 (大学院生)
- 三輪 海愛 (大学院生)
- 新川 結莉香 (学部生)
- 堀内 絢嘉 (研究生)
- 西川 美里 (テクニカルスタッフ)
- 松村 泰子 (テクニカルスタッフ)
- Ian Costa Paixao (テクニカルスタッフ)
- 佐々木 成子 (テクニカルスタッフ)
- 高岡 優貴 (テクニカルスタッフ)
- 中 侑希 (テクニカルスタッフ)
- 井田 一美 (テクニカルスタッフ)
- 須田 一真(共同研究員)
- 小暮 勇太(共同研究員)
- 松井 ゆかり(臨床研究コーディネーター)
- 吉田 宏美(臨床研究コーディネーター)
- 高橋 輝陽(臨床研究コーディネーター)
- ギブソン 友美(秘書)
- 藤原 瑠美(秘書)
- 佐多 浩子 (秘書)
発表論文
-
Novel Calmodulin Variant p.E46K Associated With Severe Catecholaminergic Polymorphic Ventricular Tachycardia Produces Robust Arrhythmogenicity in Human Induced Pluripotent Stem Cell-Derived Cardiomyocytes. Gao J, Makiyama T, Yamamoto Y, Kobayashi T, Aoki H, Maurissen TL, Wuriyanghai Y, Kashiwa A, Imamura T, Aizawa T, Huang H, Kohjitani H, Nishikawa M, Chonabayashi K, Fukuyama M, Manabe H, Nakau K, Wada T, Kato K, Toyoda F, Yoshida Y, Makita N, Woltjen K, Ohno S, Kurebayashi N, Murayama T, Sakurai T, Horie M, Kimura T.
Circ Arrhythm Electrophysiol. 2023 Mar 3:e011387. -
Disrupted CaV1.2 selectivity causes overlapping long QT and Brugada syndrome phenotypes in the CACNA1C-E1115K iPS cell model.
Kashiwa A, Makiyama T, Kohjitani H, Maurissen TL, Ishikawa T, Yamamoto Y, Wuriyanghai Y, Gao J, Huang H, Imamura T, Aizawa T, Nishikawa M, Chonabayashi K, Mishima H, Ohno S, Toyoda F, Sato S, Yoshiura KI, Takahashi K, Yoshida Y, Woltjen K, Horie M, Makita N, Kimura T.
Heart Rhythm. 2023 Jan;20(1):89-99. -
Immunosuppressants Tacrolimus and Sirolimus revert the cardiac antifibrotic properties of p38-MAPK inhibition in 3D-multicellular human iPSC-heart organoids.
Tian Y, Tsujisaka Y, Li VY, Tani K, Lucena-Cacace A*, Yoshida Y.*
Front Cell Dev Biol. 2022 Nov 11;10:1001453.* Corresponding author -
Hematopoietic stem progenitor cells with malignancy-related gene mutations in patients with acquired aplastic anemia are characterized by the increased expression of CXCR4.
Katagiri T, Espinoza JL, Uemori M, Ikeda H, Hosokawa K, Ishiyama K, Yoroidaka T, Imi T, Takamatsu H, Ozawa T, Kishi H, Yamamoto Y, Elbadry MI, Yoshida Y, Chonabayashi K, Takenaka K, Akashi K, Nannya Y, Ogawa S, Nakao S.
EJHaem. 2022 Jul 3;3(3):669-680. -
Purification of human iPSC-derived cells at large scale using microRNA switch and magnetic-activated cell sorting.
Tsujisaka Y, Hatani T, Okubo C, Ito R, Kimura A, Narita M, Chonabayashi K, Funakoshi S, Lucena-Cacace A, Toyoda T, Osafune K, Kimura T, Saito H*, Yoshida Y*.
Stem Cell Reports. 2022 Jul 12;17(7):1772-1785.* Corresponding author -
The GPI-anchored protein CD109 protects hematopoietic progenitor cells from undergoing erythroid differentiation induced by TGF-β.
Tanabe M, Hosokawa K, Nguyen MAT, Nakagawa N, Maruyama K, Tsuji N, Urushihara R, Espinoza L, Elbadry MI, Mohiuddin M, Katagiri T, Ono M, Fujiwara H, Chonabayashi K, Yoshida Y, Yamazaki H, Hirao A, Nakao S.
Leukemia. 2022 Mar;36(3):847-855. -
Azacitidine is a potential therapeutic drug for pyridoxine-refractory female X-linked sideroblastic anemia.
Morimoto Y, Chonabayashi K, Kawabata H, Okubo C, Yamasaki-Morita M, Nishikawa M, Narita M, Inagaki A, Nakanishi K, Nagao M, Takaori-Kondo A, Yoshida Y*.
Blood Adv. 2022 Feb 22;6(4):1100-1114.* Corresponding author -
CDH18 is a fetal epicardial biomarker regulating differentiation towards vascular smooth muscle cells.
Junghof J, Kogure Y, Yu T, Verdugo-Sivianes EM, Narita M, Lucena-Cacace A*, Yoshida Y*.
NPJ Regen Med. 2022 Feb 2;7(1):14.* Corresponding author -
A versatile and robust cell purification system with an RNA-only circuit composed of microRNA-responsive ON and OFF switches.
Fujita Y, Hirosawa M, Hayashi K, Hatani T, Yoshida Y, Yamamoto T, Saito H.
Sci Adv. 2022 Jan 7;8(1):eabj1793. -
Recent progress of iPSC technology in cardiac diseases.
Funakoshi S, Yoshida Y*.
Arch Toxicol. 2021 Dec;95(12):3633-3650. * Corresponding author - Expression dynamics of HAND1/2 in in vitro human cardiomyocyte differentiation.
Okubo C, Narita M, Inagaki A, Nishikawa M, Hotta A, Yamanaka S, Yoshida Y*.
Stem Cell Reports. 2021 Jul 8:S2213-6711(21)00322-2. * Corresponding author - ERRγ enhances cardiac maturation with T-tubule formation in human iPSC-derived cardiomyocytes.
Miki K, Deguchi K, Nakanishi-Koakutsu M, Lucena-Cacace A, Kondo S, Fujiwara Y, Hatani T, Sasaki M, Naka Y, Okubo C, Narita M, Takei I, Napier S, Sugo T, Imaichi S, Monjo T, Ando T, Tamura N, Imahashi K, Nishimoto T, and Yoshida Y*.
Nat Commun. 2021 Jun 21;12(1):3596. * Corresponding author - A frequent nonsense mutation in exon 1 across certain HLA-A and -B alleles in leukocytes of patients with acquired aplastic anemia.
Mizumaki H, Hosomichi K, Hosokawa K, Yoroidaka T, Imi T, Zaimoku Y, Katagiri T, Anh Thi Nguyen M, Cao Tran D, Ibrahim Yousef Elbadry M, Chonabayashi K, Yoshida Y, Takamatsu H, Ozawa T, Azuma F, Kishi H, Fujii Y, Ogawa S, Tajima A, Nakao S.
Haematologica. 2021 Jun 1;106(6):1581-1590. - Characterization of hiPSC-Derived Muscle Progenitors Reveals Distinctive Markers for Myogenic Cell Purification Toward Cell Therapy.
Nalbandian M, Zhao M, Sasaki-Honda M, Jonouchi T, Lucena-Cacace A, Mizusawa T, Yasuda M, Yoshida Y, Hotta A, Sakurai H.
Stem Cell Reports. 2021 Apr 13;16(4):883-898. - Making Cardiomyocytes from Pluripotent Stem Cells.
Karagiannis P, Yoshida Y*.
Methods Mol Biol. 2021;2320:3-7. doi: 10.1007/978-1-0716-1484-6_1. * Corresponding author - Isolation of Cardiomyocytes Derived from Human Pluripotent Stem Cells using miRNA switches.
Miki K, Saito H*, Yoshida Y*.
Methods Mol Biol. 2021;2320:35-51. * Corresponding author - Application of FluoVolt membrane potential dye for induced pluripotent stem cell-derived cardiac single cells and monolayers differentiated via embryoid bodies.
Takaki T, Yoshida Y*.
Methods Mol Biol. 2021;2320:101-110. * Corresponding author - Characterization of ventricular and atrial cardiomyocyte subtypes from human induced pluripotent stem cells.
Kakutsu M, Takaki T, Miki K, Yoshida Y*.
Methods Mol Biol. 2021;2320:135-149. * Corresponding author - A method for contraction force measurements of hiPSC-derived engineered cardiac tissues.
Fujiwara Y, Deguchi K, Miki K, Nishimoto T, Yoshida Y*.
Methods Mol Biol. 2021;2320:171-180. * Corresponding author - RNA-sequencing analysis of differentially expressed genes in human iPSC-derived cardiomyocytes.
Okubo C*, Narita M, Yamamoto T*, Yoshida Y*.
Methods Mol Biol. 2021;2320:193-217. * Corresponding author - Analysis of Transcriptional Profiling of Chamber-specific Human Cardiac Myocytes Derived from Pluripotent Stem Cells.
Lucena-Cacace A*, Yoshida Y*.
Methods Mol Biol. 2021;2320:219-232. * Corresponding author - Transplantation of Human Induced Pluripotent Stem Cell-derived Cardiomyocytes in a Mouse Myocardial Infarction Model.
Hatani T, Yoshida Y*.
Methods Mol Biol. 2021;2320:285-293. * Corresponding author - Efficient Method to Dissociate Induced Pluripotent Stem Cell-Derived Cardiomyocyte Aggregates into Single Cells.
Ito E, Miyagawa S, Yoshida Y, Sawa Y.
Methods Mol Biol. 2021;2320:29-33. - Overview of the 84th Annual Scientific Meeting of the Japanese Circulation Society - Change Practice!
Ono K, Shizuta S, Yamamoto E, Saito N, Ozasa N, Kato T, Kato E, Horie T, Tazaki J, Shiomi H, Watanabe S, Watanabe H, Yamashita Y, Yoshikawa Y, Kinoshita H, Makiyama T, Yoshida Y, Ashida N, Nakagawa Y, Nakashima Y, Baba O, Kohjitani H, Kimura M, Inazumi H, Yoshizawa T, Komasa A, Kimura T.
Circ J. 2021 Feb 25;85(3):323-329 - Fukushima H, Yoshioka M, Kawatou M, López-Dávila V, Takeda M, Kanda Y, Sekino Y, Yoshida Y, Yamashita JK.
Specific induction and long-term maintenance of high purity ventricular cardiomyocytes from human induced pluripotent stem cells.
PLoS One. 2020 Nov 2;15(11):e0241287. - Okamoto R, Goto I, Nishimura Y, Kobayashi I, Hashizume R, Yoshida Y, Ito R, Kobayashi Y, Nishikawa M, Ali Y, Saito S, Tanaka T, Sawa Y, Ito M, Dohi K.
Gap junction protein beta 4 plays an important role in cardiac function in humans, rodents, and zebrafish.
PLoS One. 2020 Oct 13;15(10):e0240129. - Hirose S, Makiyama T, Melgari D, Yamamoto Y, Wuriyanghai Y, Yokoi F, Nishiuchi S, Harita T, Hayano M, Kohjitani H, Gao J, Kashiwa A, Nishikawa M, Wu J, Yoshimoto J, Chonabayashi K, Ohno S, Yoshida Y, Horie M, Kimura T.
Propranolol Attenuates Late Sodium Current in a Long QT Syndrome Type 3-Human Induced Pluripotent Stem Cell Model.
Front Cell Dev Biol. 2020 Aug 13;8:761. - Kuwabara Y, Tsuji S, Nishiga M, Izuhara M, Ito S, Nagao K, Horie T, Watanabe S, Koyama S, Kiryu H, Nakashima Y, Baba O, Nakao T, Nishino T, Sowa N, Miyasaka Y, Hatani T, Ide Y, Nakazeki F, Kimura M, Yoshida Y, Inada T, Kimura T, Ono K.
Lionheart LincRNA alleviates cardiac systolic dysfunction under pressure overload.
Commun Biol. 2020 Aug 13;3(1):434. - Nguyen MAT, Hosokawa K, Yoroidaka T, Maruyama H, Espinoza JL, Elbadry MI, Mohiuddin M, Tanabe M, Katagiri T, Nakagawa N, Chonabayashi K, Yoshida Y, Arima N, Kashiwase K, Saji H, Ogawa S, Nakao S.
Resistance of KIR Ligand-Missing Leukocytes to NK Cells In Vivo in Patients with Acquired Aplastic Anemia.
Immunohorizons. 2020 Jul 17;4(7):430-441. - Acute myeloid leukemia with a cryptic NUP98/PRRX2 rearrangement developing after low-dose methotrexate therapy for rheumatoid arthritis.
Chonabayashi K, Yoshida Y, Kitawaki T, Nannya Y, Nakamura M, Oshima S, Hishizawa M, Yamashita K, Ogawa S, Takaori-Kondo A.
Ann Hematol. 2019 Dec;98(12):2841-2843. - Elbadry MI, Mizumaki H, Hosokawa K, Espinoza JL, Nakagawa N, Chonabayashi K, Yoshida Y, Katagiri T, Hosomichi K, Zaimoku Y, Imi T, Nguyen MAT, Fujii Y, Tajima A, Ogawa S, Takenaka K, Akashi K, Nakao S.
Escape hematopoiesis by HLA-B5401-lacking hematopoietic stem progenitor cells in men with acquired aplastic anemia.
Haematologica. 2019 Oct;104(10):e447-e450. - Towards Precision Medicine With Human iPSCs for Cardiac Channelopathies.
Wu JC, Garg P, Yoshida Y, Yamanaka S, Gepstein L, Hulot JS, Knollmann BC, Schwartz PJ.
Circ Res. 2019 Aug 30;125(6):653-658. - Targeted Disruption of HLA Genes via CRISPR-Cas9 Generates iPSCs with Enhanced Immune Compatibility.
Xu H, Wang B, Ono M, Kagita A, Fujii K, Sasakawa N, Ueda T, Gee P, Nishikawa M, Nomura M, Kitaoka F, Takahashi T, Okita K, Yoshida Y, Kaneko S, Hotta A.
Cell Stem Cell. 2019 Apr 4;24(4):566-578.e7. - Takaki T, Inagaki A, Chonabayashi K, Inoue K, Miki K, Ohno S, Makiyama T, Horie M, Yoshida Y*.
Optical recording of action potentials in human induced pluripotent stem cell-derived cardiac single cells and monolayers generated from long QT syndrome type 1 patient.
Stem Cells Int. 2019 Mar 6;2019;7532657. * Corresponding author - Karagiannis P, Takahashi K, Saito M, Yoshida Y, Okita K, Watanabe A, Inoue H, Yamashita J, Todani M, Nakagawa M, Osawa M, Yashiro Y, Yamanaka S, Osafune K.
Induced Pluripotent Stem Cells and Their Use in Human Models of Disease and Development.
Physiol Rev. 2019 Jan 1;99(1):79-114. - Hatani T, Funakoshi S, Deerinck TJ, Bushong EA, Kimura T, Takeshima H, Ellisman MH, Hoshijima M, Yoshida Y*.
Nano-structural analysis of engrafted human induced pluripotent stem cell-derived cardiomyocytes in mouse hearts using a genetic-probe APEX2.
Biochem Biophys Res Commun. 2018 Nov 10;505(4):1251-1256. * Corresponding author - Wuriyanghai Y, Makiyama T*, Sasaki K, Kamakura T, Yamamoto Y, Hayano M, Harita T, Nishiuchi S, Chen J, Kohjitani H, Hirose S, Yokoi F, Gao J, Chonabayashi K, Watanabe K, Ohno S, Yoshida Y*, Kimura T, Horie M.
Complex aberrant splicing in the induced pluripotent stem cell-derived cardiomyocytes from a patient with long-QT syndrome carrying KCNQ1-A344Aspl mutation.
Heart rhythm 2018 Oct;15(10):1566-1574. * Corresponding author - Hatani T, Miki K, Yoshida Y*.
Induction of Human Induced Pluripotent Stem Cells to Cardiomyocytes Using Embryoid Bodies.
Methods Mol Biol. 2018;1816:79-92. * Corresponding author - Espinoza JL, Elbadry MI, Chonabayashi K, Yoshida Y, Katagiri T, Harada K, Nakagawa N, Zaimoku Y, Imi T, Hassanein HA, Khalifa A Noreldin A, Takenaka K, Akashi K, Hamana H, Kishi H, Akatsuka Y, Nakao S.
Hematopoiesis by iPSC-derived hematopoietic stem cells of aplastic anemia that escape cytotoxic T-cell attack.
Blood Adv. 2018 Feb 27;2(4):390-400. - Takeda M, Kanki Y, Masumoto H, Funakoshi S, Hatani T, Fukushima H, Izumi-Taguchi A, Matsui Y, Shimamura T, Yoshida Y, Yamashita JK.
Identification of Cardiomyocyte-Fated Progenitors from Human-Induced Pluripotent Stem Cells Marked with CD82.
Cell Rep. 2018 Jan 9;22(2):546-556. - Hayano M, Makiyama T*, Kamakura T, Watanabe H, Sasaki K, Funakoshi S, Wuriyanghai Y, Nishiuchi S, Harita T, Yamamoto Y, Kohjitani H, Hirose S, Yokoi F, Chen J, Baba O, Horie T, Chonabayashi K, Ohno S, Toyoda F, Yoshida Y*, Ono K, Horie M, Kimura T.
The Development of a Patient-Derived Induced Pluripotent Stem Cell Model for the Investigation of SCN5A-D1275N-Related Cardiac Sodium Channelopathy.
Circ J. 2017 Nov 24;81(12):1783-1791. * Corresponding author - Kawamura M, Miyagawa S, Fukushima S, Saito A, Miki K, Funakoshi S, Yoshida Y, Yamanaka S, Shimizu T, Okano T, Daimon T, Toda T, Sawa Y.
Enhanced Therapeutic Effects of Human iPS Cell Derived-Cardiomyocyte by Combined Cell-Sheets with Omental Flap Technique in Porcine Ischemic Cardiomyopathy Model.
Sci Rep. 2017 Aug 18;7(1):8824 - Yoshida Y*, Yamanaka S.
Induced Pluripotent Stem Cells Ten Years Later: For Cardiac Applications
Circ Res. 2017 Jun 9;120(12):1958-1968. * Corresponding author - Kuang Y, Miki K, Parr CJ, Hayashi K, Takei I, Li J, Iwasaki M, Nakagawa M, Yoshida Y, Saito H.
Efficient and Selective Removal of Human Pluripotent Stem Cells via Ecto-Alkaline Phosphatase-Mediated Aggregation of Synthetic Peptides
Cell Chemical Biology. 2017 Jun 22;24(6):685-694.e4 - Nakanishi H, Miki K, Komatsu KR, Umeda M, Mochizuki M, Inagaki A, Yoshida Y, Saito H.
Monitoring and visualizing microRNA dynamics during live cell differentiation using microRNA-responsive non-viral reporter vectors
Biomaterials. 2017 Jun;128:121-135. - Yamamoto Y, Makiyama T*, Harita T, Sasaki K, Wuriyanghai Y, Hayano M, Nishiuchi S, Kohjitani H, Hirose S, Chen J, Yokoi F, Ishikawa T, Ohno S, Chonabayashi K, Motomura H, Yoshida Y*, Horie M, Makita N*, Kimura T.
Allele-specific ablation rescues electrophysiological abnormalities in a human iPS cell model of long-QT syndrome with a CALM2 mutation
Hum Mol Genet. 2017 May 1;26(9):1670-1677. * Corresponding author - Ueki J, Nakamori M, Nakamura M, Nishikawa M, Yoshida Y, Tanaka A, Morizane A, Kamon M, Araki T, Takahashi MP, Watanabe A, Inagaki N, Sakurai M.
Myotonic dystrophy type 1 patient-derived iPSCs for the investigation of CTG repeat instability
Sci Rep. 2017 Feb 13;7:42522. - Sasaki K, Makiyama T*, Yoshida Y*, Wuriyanghai Y, Kamakura T, Nishiuchi S, Hayano M, Harita T, Yamamoto Y, Kohjitani H, Hirose S, Chen J, Itoh H, Kawamura M, Ohno S, Takeuchi A, Matsuoka S, Miura M, Sumitomo N, Horie M, Yamanaka S, Kimura T.
Patient-specific Human Induced Pluripotent Stem Cell Model Assessed with Electrical Pacing Validates S107 as a Potential Therapeutic Agent for Catecholaminergic Polymorphic Ventricular Tachycardia.
Plos One. 2016 Oct 20;11(10):e0164795. * Corresponding author - Parr CJ, Katayama S, Miki K, Kuang Y, Yoshida Y, Morizane A, Takahashi J, Yamanaka S, Saito H.
MicroRNA-302 switch to identify and eliminate undifferentiated human pluripotent stem cells.
Sci Rep. 2016 Sep 9;6:32532. - Nishizawa M, Chonabayashi K, Nomura M, Tanaka A, Nakamura M, Inagaki A, Nishikawa M, Takei I, Oishi A, Tanabe K, Ohnuki M, Yokota H, Koyanagi-Aoi M, Okita K, Watanabe A, Takaori-Kondo A, Yamanaka S, Yoshida Y*
Epigenetic variation between human induced pluripotent stem cell lines is an indicator of differentiation capacity.
Cell Stem Cell. 2016 Sep 1;19(3):341-54. * Corresponding author - Oceguera-Yanez F, Kim SI, Matsumoto T, Tan GW, Xiang L, Hatani T, Kondo T, Ikeya M, Yoshida Y, Inoue H, Woltjen K.
Engineering the AAVS1 locus for consistent and scalable transgene expression in human iPSCs and their differentiated derivatives.
Methods. 2016 May 15;101:43-55. - Kawamura T, Miyagawa S, Fukushima S, Maeda A, Kashiyama N, Kawamura A, Miki K, Okita K, Yoshida Y, Shiina T, Ogasawara K, Miyagawa S, Toda K, Okuyama H, Sawa Y.
Cardiomyocytes Derived from MHC-Homozygous Induced Pluripotent Stem Cells Exhibit Reduced Allogeneic Immunogenicity in MHC-Matched Non-human Primates.
Stem Cell Reports. 2016 Mar 8;6(3):312-20 - Morita Y, Andersen P, Hotta A, Tsukahara Y, Sasagawa N, Hayashida N, Koga C, Nishikawa M, Saga Y, Evans SM, Koshiba-Takeuchi K, Nishinakamura R, Yoshida Y, Kwon C, Takeuchi JK.
Sall1 transiently marks undifferentiated heart precursors and regulates their fate.
J Mol Cell Cardiol. 2016 Mar;92:158-62 - Yoshida Y*, Yamanaka S.
Understanding Intracellular Signaling Advances Cardiac Reprogramming Technology Toward Clinical Applications.
Circ Res. 2016 Feb 5;118(3):377-8. * Corresponding author - Funakoshi S, Miki K, Takaki T, Okubo C, Hatani T, Chonabayashi K, Nishikawa M, Takei I, Oishi A, Narita M, Hoshijima M, Kimura T, Yamanaka S, Yoshida Y*
Enhanced engraftment, proliferation, and therapeutic potential in heart using optimized human iPSC-derived cardiomyocytes.
Sci Rep. 2016 Jan 8;6:19111. * Corresponding author - Miki K, Endo K, Takahashi S, Funakoshi S, Takei I, Katayama S, Toyoda T, Kotaka M, Takaki T, Umeda M, Okubo C, Nishikawa M, Oishi A, Narita M, Miyashita I, Asano K, Hayashi K, Osafune K, Yamanaka S, Saito H*, Yoshida Y*.
Efficient Detection and Purification of Cell Populations Using Synthetic MicroRNA Switches
Cell Stem Cell. 2015 Jun 4;16(6):699-711. * Corresponding author - Tokunaga K, Saitoh N, Goldberg I, Sakamoto C, Yasuda Y, Yoshida Y, Yamanaka S, Nakao M.
Computational image analysis of colony and nuclear morphology to evaluate human induced pluripotent stem cells
Sci Rep. 2014 Nov 11;4:6996. - Nakagawa M, Taniguchi Y, Senda S, Takizawa N, Ichisaka T, Asano K, Morizane A, Doi D, Takahashi J, Nishizawa M, Yoshida Y, Toyoda T, Osafune K, Sekiguchi K, Yamanaka S.
A novel efficient feeder-free culture system for the derivation of human induced pluripotent stem cells.
Sci Rep. 2014 Jan 8;4:3594. - Miki K, Yoshida Y*, Yamanaka S.
Making Steady Progress on Direct Cardiac Reprogramming Toward Clinical Application
Circ Res. 2013 Jun 21;113(1):13-5. * Corresponding author - Kamakura T, Makiyama T*, Sasaki K, Yoshida Y*, Wuriyanghai Y, Chen J, Hattori T, Ohno S, Kita T, Horie M, Yamanaka S, Kimura T.
Ultrastructural Maturation of Human-Induced Pluripotent Stem Cell-Derived Cardiomyocytes in a Long-Term Culture.
Circ J. 2013 Apr 25;77(5):1307-14. * Corresponding author - Yoshida Y*, Yamanaka S.
An emerging strategy of gene therapy for cardiac disease.
Circ Res. 2012 Oct 12;111(9):1108-10. * Corresponding author - Yoshida Y*, Yamanaka S*
Labor pains of new technology: direct cardiac reprogramming
Circ Res. 2012 Jun 22;111(1):3-4 * Corresponding author - Yoshida Y*, Yamanaka S*
iPS cells : A source of cardiac regeneration
J Mol Cell Cardiol. 2011 Feb;50(2):327-32 * Corresponding author - Yoshida Y*, Yamanaka S*
Induced pluripotent stem cells for disease modeling and stem cell-based regeneration
Circulation. 2010 Jul 6;122(1):80-87 * Corresponding author - Yoshida, Y*, Takahashi, K, Okita, K, Ichisaka, T, and Yamanaka, S*.
Hypoxia enhances the generation of induced pluripotent stem cells
Cell Stem Cell. 2009 Sep 4;5(3):237-241. * Corresponding author - Nakashima Y, Ono K, Yoshida Y, Kojima Y, Kita T, Tanaka M, Kimura T.
The search for Nkx2-5-regulated genes using purified embryonic stem cell-derived cardiomyocytes with Nkx2-5 gene targeting
Biochem Biophys Res Commun. 2009 Dec 18;390(3):821-826 - Kojima Y, Ono K, Inoue K, Takagi Y, Kikuta K, Nishimura M, Yoshida Y, Nakashima Y, Matsumae H, Furukawa Y, Mikuni N, Nobuyoshi M, Kimura T, Kita T, Tanaka M.
Progranulin expression in advanced human atherosclerotic plaque.
Atherosclerosis. 2009 Sep;206(1):102-8 - Matsumae H, Yoshida Y, Ono K, Togi K, Inoue K, Furukawa Y, Nakashima Y, Kojima Y, Nobuyoshi M, Kita T, Tanaka M.
CCN1 knockdown suppresses neointimal hyperplasia in a rat artery balloon injury model.
Arterioscler Thromb Vasc Biol. 2008 Jun;28(6):1077-83. - Yoshida Y, Togi K, Matsumae H, Nakashima Y, Kojima Y, Yamamoto H, Ono K, Nakamura T, Kita T, Tanaka M.
CCN1 protects cardiomyocytes from oxidative stress via beta1 integrin-Akt pathway.
Biochem Biophys Res Commun. 2007 Apr 13; 355(3):611-8. - Kawamoto T, Togi K, Yamauchi R, Yoshida Y, Nakashima Y, Kita T, Tanaka M.
Endothelin-1 activates Homer 1alpha expression via mitogen-activated protein kinase in cardiac myocytes.
Int J Mol Med. 2006 Jul;18(1):193-6. - Togi K, Yoshida Y, Matsumae H, Nakashima Y, Kita T, Tanaka M.
Essential role of Hand2 in interventricular septum formation and trabeculation during cardiac development
Biochem Biophys Res Commun. 2006 Apr 28; 343 (1):144-51. - Togi K, Kawamoto T, Yamauchi R, Yoshida Y, Kita T, Tanaka M.
Role of Hand1/eHAND in the dorso-ventral patterning and interventricular septum formation in the embryonic heart.
Mol Cell Biol. 2004 Jun; 24(11):4627-35.
関連リンク
メンバー募集
大学院生を募集しています。
iPS細胞の臨床応用に向けた研究に興味のある方、心疾患の新しい治療法の開発や創薬に興味のある方、吉田までご連絡ください。
- E-mail: yoshida-g*cira.kyoto-u.ac.jp
- お手数ですがメール送信の際*を@に変えてください。

