HOME > 研修医・学生の皆さんへ > 夏期海外研修に行かれた皆さんの声 > 2016年度 > UCLA
UCLA
UCLA海外研修レポート 京都大学医学部医学科4回生 藤島 雄幸
研修期間・機関 2016/9/19~2016/9/30
配属先 京都大学医学部附属病院循環器内科
University of California Los Angels
Molecular, Cell, and Developmental Biology
活動内容 心臓発生・分化に関する研究
1. 背景・目的
今回のマイコースプログラムではUCLAにて心臓発生・分化に関する研究をされている中野先生の研究室でお世話になりました。はじめにその経緯について記載しようと思います。実習先として希望させていただいたのには、主に以下の2つの理由からでした。
①循環器内科に興味を抱いていたから
②アメリカの大学へ留学してみたかったから
まずは①について記載しようと思います。私は大学1年生の夏休みに早期体験実習(大学のプログラムの一つ)で天理よろづ相談所病院の循環器内科で1週間ほど勉強させていただいた経験がありました。当時は入学して間もない頃で大した知識もありませんでしたが様々なことを学ばせていただき、今思い返せば循環器内科に興味を抱くこととなった最初のきっかけでした。そして昨年のS1講義で循環器について学習してより一層興味を抱くようになりました。これまでラボに通っていた経験もなく、マイコースプログラムは興味のある科でお世話になろうと考えておりました。 次に②についてですが、私は幼い頃からアメリカの大学に留学することに憧れていました。本やテレビでは見たり聞いたりしたことはあったのですが、実際に行って自分の眼で見て色んなことを肌で感じてみたいという思いがありました。
そこで昨年の2月頃、本プログラムについて京大循環器内科の木村剛教授にお願いしたところ、快く引き受けて下さいました。その後、尾野亘准教授にUCLAの中野先生と連絡をとっていただき、実習期間の調整をしていただきました。

(UCLAにて記念撮影)
2. 活動内容
UCLAの研究室では先生方の実験を見学させていただいたり、論文の抄読会を行ったり、ラボミーティングに参加させていただいたりもしましたが、本稿では自分が行った実験について主に記載したいと思います。滞在期間が2週間ほどということもあり、あまり大掛かりな実験はできませんでしたが、基本的な実験手技を学ばせていただくとともにP4マウスの心臓切片の作製・染色をさせていただきました。
・マウスの切開、心臓の取り出し
・組織の固定 ・心臓切片の作製(4 chamber)
・HE染色
・観察ならびに考察
先生方に見本を見せていただき、向こうのラボ学生(UCLAの学部生)と一緒に実験手技の習得も兼ねて自分たちが納得するまで実験をさせていただきました。中でもクライオスタット(cutting machine)を用いて切片を作製するという作業は初めのうちは中々うまくいかず、遅くまで残って練習させていただきました。
以下に手順を示します。
A)P4マウスの解剖
①throat部分に切り込みを加える
②縦方向に切開する
※肝臓まで切開すると内容物が出てきうるので注意しながら行う
③心臓が出てくるようにpressureを与え、Ao/PA等で上部が固定されているので切開する
④他組織を取り除いた後、PBS buffer液に浸し、4℃で保存する
B)bufferの交換
①transfer pipetで上記のbufferを取り除く
②十分量のPBS bufferを加えて、氷の上において30分保存する
③これらの操作を計3回繰り返した後、PBS bufferを取り除き、代わりにPBS/30%Secroseを十分量加える
④4℃の環境下で一晩保存する
C)凍結標本の作製
①transfer pipetでPBS/30%Secroseを取り除く
②OCT/30%Sucroseを加えて、氷の上において1時間保存する
③OCT/30%Sucroseを取り除き、OCT compoundに浸し1時間保存する
④OCTを十分量入れたcrio-moldに心臓を入れる
※切片作製時に4chamberが観察されるように向きを考えて入れる
⑤ドライアイスとイソプロパノールを用いて凍結させ、アルミホイルで包んで密閉した後、-20℃で保存する
D)切片の作製
クライオスタットを用いて5㎛幅の切片を作製する
E)HE染色
①PBSで5分間洗浄する (×3回)
②filtered haematoxylineに2分間浸す
③水道水で1分間洗浄する
④0.01MのNH4OHに2分間浸す
⑤水道水で5分間洗浄する (×2回)
⑥70%Ethanolに5分間浸し、脱水する (×3回)
⑦上記の操作(⑥の操作)を90%,100%Ethanolについても同様に行う
⑧eosinに2~10秒ほど浸す
⑨100%Ethanolで5分間洗浄する
⑩safeclearに5分間浸す (×2回)
⑪スライドの下縁に100㎕のpermountを塗り、スライド内に気泡ができないように カバーガラスをのせる
⑫作製標本を乾かす
3. 結果
HE染色後、観察した顕微鏡画像を以下に示します。
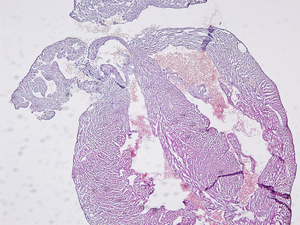
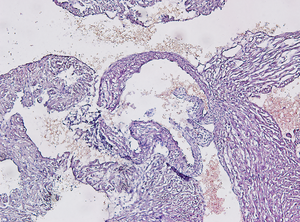
(左図の左室上方を拡大したもの)
心房部分の染まり方が少し弱いものの綺麗な4 chamberの標本を得ることができました。
右の写真は弁および周辺(左室上方部)を拡大して観察したものです。
4. 考察
今回の実験では正常マウスを扱ったため特に病的な部分も見当たらなかったので、以下染色した切片について実験過程とともに考察することにします。
“実験結果”の左写真の右の腔(右室)上方に赤い細胞が集積していることが確認されます。これは血球ですが、おそらく心臓を切除する過程において通常よりも少し時間を要してしまったことでこのような切片が出来上がったと考えられます。
また弁についてですが、弁実質と辺縁部分について染まり方に違いが確認されます。勿論HE染色だけから断定することはできませんが、弁にも心内膜にあたる内皮細胞が存在すると考えることができます。
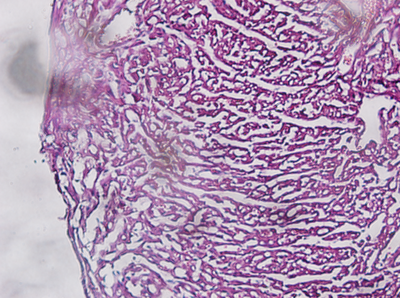
次に示した写真は左室壁の拡大写真です。Haematoxylineにより核が青藍色に、Eosinにより細胞質および線維類がピンク色に染まっていることが確認されます。P4マウスの心臓であるため、心筋細胞自体もまだ成長の過程にあると考えられますが、1つ1つの細胞の大きさについて差は見られません。したがって心筋細胞はその成長について同調性を有していると考えることができます。
~海外研修を行うにあたって~
①出発まで
既述したように私はこれまでラボに通った経験がありませんでした。そのためUCLAで実習を行う前に短期間ではありましたが京大の循環器内科の研究室で実験に関する基本的な知識や姿勢について教わりました。ただでさえ慣れない海外で実習を行うにあたって、出国前の時間はとても有意義なものでした。
また国内での実習中、数年前までUCLAの中野先生のラボで研究をされていた中島先生を紹介していただき大学周辺のお店や観光地のお話を伺いました。
②滞在中の宿泊について
当初UCLA周辺の寮や宿舎での滞在を考えていたのですが、少し高めの所が多かった印象でした。数ヶ月の滞在ならば色々とプランもあるのかもしれませんが、数週間の滞在であったこともありニーズに合った場所が見つかりませんでした。
そこで友人と話し合った結果、実習中の2週間はサンタモニカのホステル(HI-サンタモニカ)に滞在することにしました。UCLAまではバスで30~40分ほどの立地ですが、サンタモニカはとても治安の良い町でとても過ごしやすかったです。(近くにビーチやメインストリートもあり、観光やショッピングも楽しめました)
ホステルについてはセキュリティー面もしっかりしていましたし、特にトラブルに巻き込まれることもありませんでした。また色んな国の人と触れ合うことができるのもメリットの一つかもしれません。

(サンタモニカの有名な桟橋)
③休日の過ごし方について
平日は基本的にUCLAのラボで過ごすことが多かったのですが、今回は初の海外ということもあり、休日には色んな場所に足を伸ばしました。地下鉄や市バスをうまく使いこなせばロサンゼルス内の移動で不自由することはありませんでした。(料金も1.25~1.75$と安く、非常にreasonableでした)
ハリウッドやダウンタウンの街を散策したり、ドジャースタジアムに前ケンの試合を見に行ったり、重田先生にグリフィス天文台に夜景を見に連れていってもらったり、とロサンゼルスの街を十分満喫することができました。観光地になっているような場所では治安も改善されている場所が多く、特に危ない目にあうことなく過ごすことができました。
また最終日には中野先生のご自宅のホームパーティーに呼んでいただきました。パーティーにはUCLAで研究されている他の先生方やそのご家族も来られていて、様々なお話を伺うことができました。

(ドジャーズスタジアムにて vsサンフランシスコ・ジャイアンツ)
~Final score~
| Giants | 1 | 1 | 0 | 0 | 0 | 1 | 0 | 0 | 0 | 3 |
| Dodgers | 5 | 1 | 2 | 0 | 1 | 0 | 0 | 0 | × | 9 |
(前田健太…16勝目!!)
~終わりに~
アメリカへの留学は私の幼い頃からの憧れで、少し大袈裟な表現かもしれませんがまた一つ夢を叶えることができました。何不自由なく無事に実習を終えることができたのも偏に多くの先生方のサポートあってのことかと思います。
これまでラボに通ったことがなかった私にとっては何もかもが新鮮で、本プログラムを通して基礎研究に対して興味を抱くようにもなったのですが、滞在中に色んな研究者の方にそのキャリアについて話を伺うことができたことが一番の収穫であったと感じています。というのも、自分の将来のキャリアについて少しずつ考え始め出しているこの時期に、その選択肢を一つでも広げることができたからです。現在のところは臨床の分野で頑張っていきたいと考えていますが、”臨床で培った経験を研究に生かすことができる”というのと同様に”研究で培った経験を臨床に生かすことができる”ということも知ることができました。
病院実習や初期研修、あるいはその後働いていく中で自分のキャリアについての考えも変わってくるかもしれませんが、今回のマイコースを経て、海外でのキャリアも選択肢の一つとして考えていきたいと思うようになりました。
本プログラムを快く受け入れて下さった木村教授、留学先の斡旋や日程をはじめ具体的な調整を行っていただいた尾野先生、国内での実習時に様々な手技を教えていただいた堀江先生、中島先生、本当にありがとうございました。また留学中は中野敦先生、中野治子先生、重田先生には公私共にお世話になり、重ね重ね感謝に堪えません。心より御礼申し上げます。

(UCLAのラボ最終日 ラボメンバーと)
UCLA活動報告書 京都大学医学部医学科4回生 三谷 幸輝
0. はじめに
私は臨床の道に進みたいと考えてはいるが、今回のマイコースプログラムという機会を使って研究とはどのようなものなのか、また将来の選択肢の一つとして研究という仕事がどのようなものなのかを見ておきたいという気持ちがあった。もともと循環器、特に心臓という臓器の生体内でのダイナミックな機能について興味があり、また将来のキャリアとして循環器というのも選択肢の一つとしてあったので、今回の研究室選択においてはその点を考慮した。
また、普段の学習から、海外で仕事をすることを意識して勉強をしてきたので、自分の現時点での語学力や医学的知識についての能力を試して見たいという狙いもあり、循環器内科学の尾野先生にお願いし、University of California, Los Angeles (以下UCLA)で循環器発生の分子メカニズムに関する研究をしておられる中野敦先生の研究室に2週間の研修プログラムを組んでいただく運びとなった。
始めの2週間は京大の循環器内科学教室において堀江先生や中島先生、大学院生の方々の指導のもと、RNA、DNA抽出、PCRやqPCRといった実験の基本的な手技の習得に努めた。その後UCLAにて中野治子先生や重田先生の指導のもと、新生児マウスの心臓をHE染色で染め、正常な心臓構造の理解に努めた。中野先生の研究室では主に心内膜を基盤とした種々の循環器発生の分子メカニズムを研究されており、行った染色以外にも、心内膜と造血細胞の関係性を調べるための造血前駆体細胞特異的表面抗原免疫染色や、心内膜マクロファージに対するFACS analysis、cryoinjuryによる心筋の虚血性変化の観察など他にも様々な実験を見せていただいたが今回は割愛させていただく。
1. Purpose
To understand the normal structure of the heart from the pups.
2. Method
<Day 1>
-Pups dissection (4-days after birth)-
- Dissect horizontally at the cervix. It should be deep enough to make the following procedure easy.
- Cut vertically along the sternal border up to the diaphragm, not to dissect over the chest. (abdominal organs may come out of the cavity.)
- Pinch the loose skin of the back and squeeze it using left two fingers, then the heart should pop out.
- Cut the vascular connection between the heart and the body. First, you cut it at the top, and then sides of it.
- Scoop the heart out with forcep inserting from the apex to the bottom.
- Put it on the dish filled with PBS buffer.
- Remove the extra tissues from the heart to clear by using two forceps.
-Fixation-
-
Fixation was performed in each well, in which 4% PFA was poured. Dip the heart into that solution and preserve it overnight.
(You can obtain the heart from the pups and preserve it near the living condition)
<Day 2>
-Rinse-
- Change the solution in each well to 1*PBS buffer. (Fixation was performed in 4% PFA, which is toxic, so this procedure should be done in the cabinet.)
- Put the plate on ice and rock it. You should change the buffer and rinse it every 30 min about 3 times. This process can be skipped over if you do not need.
- After rinsed it, add 30% sucrose to each well enough to soak it. In order to slice it sharply, you need to make it compact and dense after rest in 30% sucrose.
<Day 3>
- After over night rest, change the solution to OCT/ sucrose(1:1). (OCT is so viscous liquid that it was mixed with sucrose.) OCT helps slice the specimen afterwards. Keep it on ice and rock it for 1 hour.
- Change OCT/ sucrose to pure OCT. Keep it on ice and rock it for 1 hour again.
-Embedding-
- Pour OCT into a small container called ''cryomold'. Put the specimen carefully in OCT in the orientation as you want to observe under the microscope. (For example, if you want 4-chamber view, put it with the apex facing frontward.)
- Put isopropanol and dry-ice in a bowl. Put the cyromold into the bowl carefully. Then, you'll obtain the specimen embedded in solid OCT. (But it's not completely frozen.) Keep it under low temperature for minutes, and pick up from the bowl, following by wrapping it by aluminum foil. (Its purpose is not to let OCT melt down. If you keep it under dry condition, it's easy to melt down.)
- Keep it in -20℃, in refrigerator.
<Day 4>
-Cutting-
-
Cut it into several sections by the machine called ''cryostat''. You obtained some slides.
(The procedure in cryostat is not to be mentioned here.)
<Day 5>
-Stain-
- Rinse the slide with PBS for 5min 3times.
- Dip in filtered hematoxylin exactly 2min.
- Washing it with tap water for 1 min.
- Dip in 0.01M NH4OH for 2 min.
- Wash it with tap water for 5min 2times.
- Dehydrate with 50%, 70%, 90%, 100%EtOH for 5min 3times each.
- Dip in eosin for 2-10sec.
- Wash with 100% EtOH for 5min.
- Pour "safeclear" from the public box to the jaw, and dip the slide in it. Make sure not to dispose of the solution. Put it back into the public box. Wait for 5min 2times.
- In order to protect the specimen, you should cover it with glass. Apply 100ul "Permount" on the lower edge of the slide. Don't make any bubble.
- Put the glass on the slide from the bottom up. Be careful not to make any bubble. Let the glass down slowly and carefully.
- Let the solution dry up to glue it.
3. Results
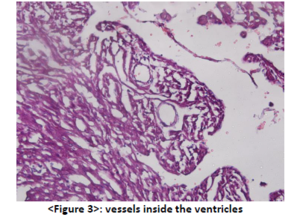
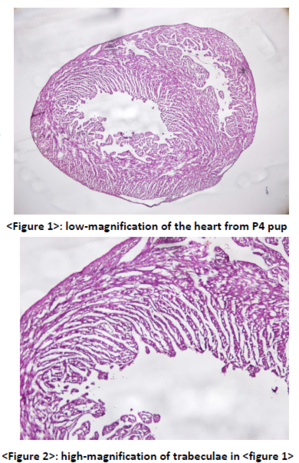 The obtained heart specimen in this experiment is shown in <Figure 1>.
The obtained heart specimen in this experiment is shown in <Figure 1>.
This slice is a horizontal section of the heart, cut from the apex, bottom-up. In the procedure 7) shown above, I got rid of the atrium with the lung altogether, it is not found in this figure. In the left of <figure1>, we can observe the left ventricle, whose wall is thick enough to pump out arterial blood to the body. Right ventricle is found in the right of <figure1>, whose wall is relatively thinner than that of left ventricle.
A number of processes in the side of the wall facing toward the lumen are found in <figure1>, especially in the left ventricle. That indicates the trabecular formation is almost completed in the P4 pups.
(Higher-magnification of trabeculae is shown in <figure2>)
4. Discussion
The development of heart is significantly complicated but occurs in an elaborate manner and well-controlled by a various molecules. In our study, though we were trying to understand the normal and whole structure of the infantile heart, we failed to obtain the complete heart, losing the atria. However, the connection between the ventricle and the atria is known to be weak. In this section, we are focusing this point.
A primitive heart is a tube-like figure. This is the result of the cranial and lateral folding of the embryo during the fourth week, which is located along the midline in the future thoracic region. ( shown in < figure4A-C >)
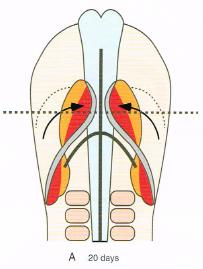
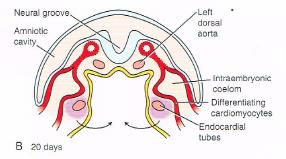
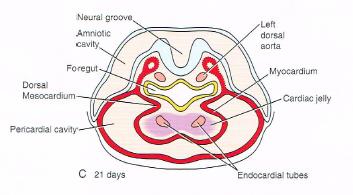
<figure 4 A-C>: Formation of the primary heart tube. A: Ventral view B,C: Cross-section
On approximately day 23, the primary heart tube begins to elongate and bend into a C-shaped structure, extending toward the right side. Formation of this bend is called looping. The primary heart tube goes on elongation even in looping, and this elongation comes to an end by day 28. After the looping, the position of each part of the heart becomes located nearly in that of matured individual. (shown in <figure 5>)
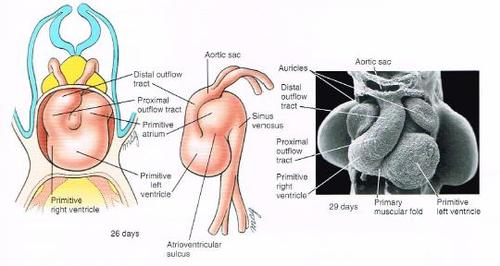
<figure 5>: The primary heart tube under the looping in day 26.
If the heart grew just in size without the structural change, a great hole between the ventricle and the atrium would remain as in day 28. (This great hole is called atrioventricular canal.) However, little hearts have no septal wall between them. In other word, there is a process to form a septum between the ventricle and the atrium during the heart development. As shown in <figure 5>, the area of the atrioventricular canal becomes narrow, allowing the septum to be easily formed. Simultaneously, it is more susceptible to the external force, leading to easy detachment. It is, hence, the result of the fragility of the connection between the ventricle and the atrium.
5.参考文献・引用
・ “Larsen’s Human Embryology 4th edition” : chapter12 ‘Development of the Heart’.
・ “Langman’s Medical Embryology 10th edition”
ここからは、ロサンゼルス滞在中の過ごし方についてです。気軽な気持ちで読んで下さい。
a) ビザや研究所への研修申込み方法について
私は、一応臨床の志望です。しかし、今回、このマイコースプログラムというせっかくの機会を利用して将来のキャリアを考えてみたいと思いました。これを機に、研究という世界を知っておきたかったし、またせっかくであれば海外の研究室と日本の研究室の両方に行くことで、研究環境や文化、考え方の違いなどを学びたくもあったので、最初に放射線生物学の武田先生にその旨を相談し、循環器内科の留学プログラムを紹介していただきました。そこで、循環器内科学の尾野先生にアポイントメントをとり、UCLA の心臓発生を研究しておられる中野先生の研究室を紹介してもらい、そこで研修させていただくことにしました。
今回の留学プログラムではビザの関係から2週間という期間で研究室に伺うことに なり、そのため今回は通常の観光でのアメリカ滞在と同じくESTA の申請のみで行くことができました。
b) 宿泊所の予約方法、宿泊所の内容(通勤、コスト、治安、反省)
短期間の留学ということもあり、大学の学生寮は使用できなかったので自分たちでホテルを取ることにしました。とはいえ、大学近辺のウエストウッドと呼ばれる地域は、治安はとても良いもののホテル代がかなり高額だったためやむをえず比較的値段が安めのユースホステルに2週間連泊で泊まることにしました。場所は、サンタモニカというL.A.でも有数の観光地にあるものの1泊50~60ドル程度で泊まれ、治安も悪くはないと思いました。一応朝食もついてはいたのですが、シリアルと食パンとバナナとオレンジジュースと牛乳というひどく質素なものだったので終盤にはかなり飽きてしまいましたが…。
ホステルの部屋は6人部屋でほぼ毎日宿泊客が入れ替わります。個人的には大丈夫でしたがあまりプライベートの空間がなく、かつ2週間という長期滞在になるので多少ストレスフルな環境であったことは否めません。ただ、いろんな国籍、人種の人と話ができ、また向こうもネイティブスピーカーでないことも多かったので、今回の旅行で一番英会話の練習が出来たのはユースホステルの中かもしれません。
洗濯機やキッチン、食堂などの設備も比較的充実しており、普通に過ごす分には全く問題はなかったです。 通学に関してですが、今回泊まったホステルから大学まではバスで50分くらいかかり、かつアメリカのバスは時間にルーズであったり、停留所で待っていてもスルーされてしまうこともあったので、困ることもありました。普段の大学は下宿から自転車で通学しているので、バスで、しかも見慣れない街の中を長時間かけて通学するのは個人的に新鮮で楽しかったです。一回の乗車運賃は1.75ドルで、毎日通うことを考えると1週間の乗り放題券の方が安かったのでそれを購入して通学していました。観光には、L.A.の交通局が運営しているMetroというバスと電車が便利だったのでそちらを使ったりもしていました。
一番出費がかさんだのは食費でした。外食するとチップも含め10ドル弱がすぐ飛んでいってしまうので、終盤はホステルのキッチンでパスタくらいの簡単な自炊をして節約していました。ただ、昼食はそんなこともできなかったので大学の食堂を利用していました。京大にあるようなアラカルト方式の食堂ではなく、吉野家やサブウェイのような外部の飲食店が何店舗か入ったフードコートのような食堂で、3つくらいあったのですがすべてそのような形式でした。研究室から近く、一番よく通っていた食堂は、昔まで「ボムシェルター」と呼ばれるほど汚かったらしいですが最近改装されてとてもきれいでした。どの食堂でも選べるメニューの数が多く、また文字だけで料理のイメージが出来ないものばかりで、最初は食べたいものが食べられなかった記憶しかないですが、良い英語の勉強になったと思います。お昼の時間帯にはかなり食堂は混み合っていましたが回転が早いのであまり待つこともなく食べられました。
ウエストウッド自体が学生の街なので大学の外に行けば観光地などで食べるよりも安価な飲食店が数多く見受けられました。大学の近くにはRalphsというチェーンのスーパーマーケットもあり、自炊の食料や、間食なども調達したりしていました。
c) 週末の過ごし方について
 宿泊していたサンタモニカはビーチが有名な観光地だったのでそこを観光したりしていました。 地中海性の気候ということもあり空気も非常に乾燥していて雨が降ることはおろか、曇ることすらもほとんどなかったです。サンタモニカ・ピアーという場所が観光名所らしく、そこにはルート66の終点もありました。週末ということもあり、たくさんの観光客やパフォーマーたちで非常に賑わっていました。
宿泊していたサンタモニカはビーチが有名な観光地だったのでそこを観光したりしていました。 地中海性の気候ということもあり空気も非常に乾燥していて雨が降ることはおろか、曇ることすらもほとんどなかったです。サンタモニカ・ピアーという場所が観光名所らしく、そこにはルート66の終点もありました。週末ということもあり、たくさんの観光客やパフォーマーたちで非常に賑わっていました。

海から離れるとピアー以外にもショッピングや食事が楽しめるストリートがあり、そこを歩くだけでもかなり楽しめました。いろいろ見て回る際にも、サンタモニカの道は南北が番号+St(street)、東西が州の名前+Blvd(boulevard)になっていて比較的わかりやすい構造になっていたので観光しやすかったです。

私たちが街を歩いているときにはちょうどマーケットも開催されており、道が一本まるまる歩行者天国になっていて地元の特産品、野菜や果物、肉や魚などいろいろなものが売られており、非常に活気づいていました。 大都市の観光地でこのようなマーケットがあるというのはなかなか日本では経験がないので新鮮で見ていて楽しかったです。

サンタモニカから少し南の方に歩くとベニスというエリアに入ります。ここはL.A.の中でもメキシカンな雰囲気が強く、ヒスパニックや黒人が多くサンタモニカとはまた違った良さがありました。サンタモニカに比べると少し治安は悪くなるかもしれませんが、それでも危険を感じるほどのものではなかったです。
L.A.自体の治安はかなり良くなってはいるそうですが、1本道が違うだけで危険なところはまだ少なからず残っているそうです。観光する際は必ず下調べしてから行くことをおすすめします。
d) 最後に
今回の マイコースプログラムを通して、研究というものが大まかにどういうもので、どのように進めていくのかという大枠は理解できました。日本での2週間とアメリカでの2週間という短い期間の中で出来ることは限られていたものの、新しく学ぶことが非常に多く、普段の臨床講義や実習を受けているだけでは決してわかりえないことも多々ありました。特に、今回海外の大学に行ったことで、日本との文化や設備、制度などの違いについても知ることが出来ましたし、今後の勉強に対するモチベーションもかなり上がりました。実験の手技に関してはやはりこの短期間で習得するのは不可能でしたが、海外での経験や、英語でのコミュニケーションを図ることが出来たことは自分にとって大きな経験であり、自信につながりました。必ず、将来のキャリアに役立つものだと思います。とはいえ、まだまだ英語の能力に関しても、医学の知識に関しても拙いことは確かなので、これからも努力を続けていきたいと思います。最後になりましたが、今回の留学の手配にご尽力していただいた木村先生、尾野先生、国内での実験でご指導いただいた堀江先生、中島先生、UCLAで受け入れていただいた中野敦先生、懇切丁寧にご指導頂いた中野治子先生、重田先生、留学の相談にのっていただいた放射線生物学の武田先生、その他ご指導いただいたすべての先生方にこの場を借りて御礼申し上げます。


