HOME > 研修医・学生の皆さんへ > 夏期海外研修に行かれた皆さんの声 > 2013年度 > NYU
NYU
NYU研修レポート 京都大学医学部医学科4回生 川端 智也
所属分野名:循環器内科
期間:2013年8月26日〜9月20日
活動内容(概略):動脈硬化の発生原因やリスクに関係する遺伝子を中心に、循環器内科における研究の体験
0. はじめに
マイコースプログラムの一環として、4週間に渡り、ニューヨークのNew York Universityにて研修させて頂きました。快く受け入れてくださったFisher研の西仁勇先生、Rifkin研の堀口真仁先生、並びにボスのDr. Edward FisherとDr. Daniel Rifkin、また本実習を斡旋して頂いた循環器内科の尾野亘先生、有り難うございました。
1. 準備
基礎的な実験手技に不安があったため、京大病院の循環器内科において、尾野先生の下、1週間程練習をさせていただきました。培養した菌をピックアップするところから、MIDIプレップ、ミニプレップ、更にPCMとその結果の解析まで、一通り体験させて頂くことができました。
2. Fisher研にて
Fisher研では、西先生の下、基礎研究における基礎的な実験手技、更に最新の動脈硬化研究を体験させて頂きました。
Fisher研の代表的な研究はApoE欠損の動脈硬化モデルのマウスから動脈硬化部位を、野生型のマウスとApoE欠損マウスに移植し、その結果から脂質異常を改善することで動脈硬化のregressionが見られるということを示すもの*であり、ApoE欠損マウスを使ったいろいろな研究を体験させて頂きました。例えばプラーク形成が好発する大動脈弓とそこに付属する三枝 (腕頭動脈、左総頸動脈、左鎖骨下動脈)をまとめて顕微鏡で切除する作業も体験させて頂き、他の研究員の作業も観させて頂きましたが、ApoE KOマウスはとても綺麗にプラークが形成されているのが確認できました。
マウスを開腹して臓器を摘出し、溶かしてRNAを抽出、更にcDNAを作成してDNAを作成、PCRで増幅するという一連の流れの他、ウェスタンブロッティングによる特定蛋白の存在の確認や、ナノドロップによる核酸濃度の測定など、いろいろな手技を学ばせて頂きました。中でも最新鋭であるのはLCM (Laser capture microdissection)という機械であり、癌研究等の分野では既に取り入れられているものの、動脈硬化の分野ではFisher研が先駆けであるとのことでした。簡単に説明致しますと、組織薄片(凍結組織を使用しました)から必要な部分を顕微鏡下でレーザーにより切り取るものです。Fisher研では主にApoE欠損の動脈硬化モデルマウスの大動脈弓を摘出し、LCMによりプラーク形成部分のみを採取し、発現している遺伝子を特定する、という研究**に使用されており、実際に体験させて頂きました。
西先生には各手技の原理から非常にわかりやすく、丁寧にご指導頂きました。実習終了時には吸収しきることができたか不安な部分もございましたが、早速次にお世話になったRifkin研でも経験を活かすことができました。西先生、並びにラボの皆様に厚く御礼申し上げます。
*Ernane D. Reis, MD et al. (2001) Dramatic remodeling of advanced atherosclerotic plaques of the apolipoprotein E-deficient mouse in a novel transplantation model. Journal of Vascular Surgery Volume 34, Issue 3, September 2011, Pages 541-547, 2A
**Trogan, Eugene et al. (2001). Laser capture microdissection analysis of gene expression in macrophages from atherosclerotic lesions of apolipoprotein E-deficient mice. Proc Nati Acad Sci USA. 2002 February 19; 99(4): 2234-2239
3. Rifkin研にて
Rifkin研では、主にTGF-βの役割に着目した研究を行っていました。その中でも、LTBP (latent transforming growth factor-beta binding protein) に最も着目しており、その研究を実際に体験させて頂きました。以下その研究の経過を簡潔に記載します。
3-1. 実験の背景
LTBPには4種類あり、その中でもLTBP3は不活性なTGFに結合して、肺動脈などで重要な役割を果たしそうであり、LTBP3を発現するプラスミドの必要性から、マウスのLTBP3をクローニングすることになった。
3-2. 方法
- プライマーの設計: LTBP3が3.7kb程度であるため、両端のプライマー(LTBPF, LTBPR)の他に、シークエンシング用のプライマー(SEQ1,SEQ2)も設計した。
- 組織の摘出: LTBP3の発現していそうな組織、今回はマウスの肝臓、腎臓、肺を摘出し、2mm立方程度をとり、安定化した。
- RNA抽出
- 逆転写、cDNA作成
- PCRで増幅
- アガロースゲル電気泳動: 3.7kb程度のcDNAの存在を確認し、その部分のゲルを切り取る。
- ゲルを溶解、in fusion kitでベクターpEF6にクローニング
- 大腸菌に導入、サブクローニング
- コロニーからミニプレップでプラスミドDNAを精製
- 制限酵素(EcoR1, Xba1)で切断、電気泳動で確認
- シークエンシング
各段階での詳細は3-3に記載する。
3-3. 結果
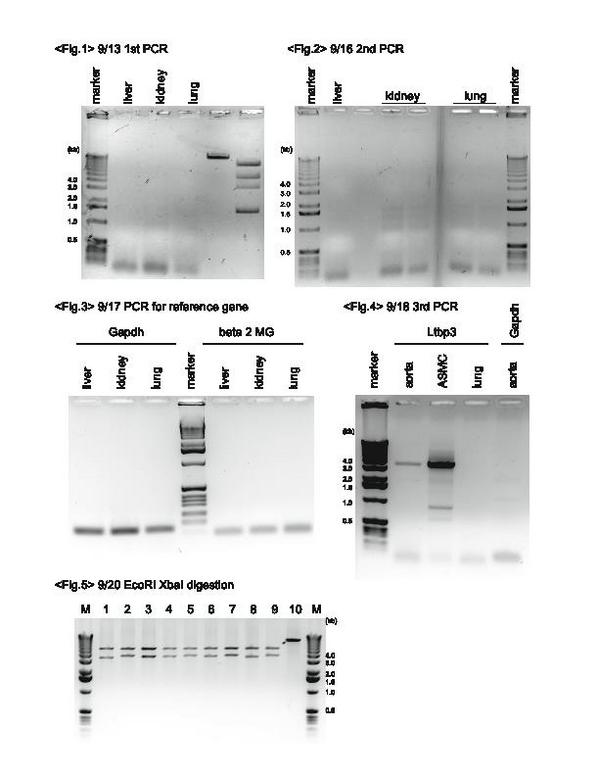
PCR後の電気泳動で問題が発覚した。この実験の標的であるLTBP3は3.7kb程度であるので、電気泳動すると3.0kbと4.0kbのマーカーの間にバンドが出現する筈である。しかしFig.1に示すとおり、肝臓、腎臓、肺の何れにもそれらしいものは見当たらない。そのため、PCRによる増幅が不十分(つまりcDNAの作成には問題が無い)と判断し、PCRサイクルを変更することにした。設計したプライマーのTmがLTBPF: 82.7℃, LTBPR: 79.7℃と伸長反応の温度68℃よりも高い為、2stepにし、かつサイクル数を増やした。一回目と二回目のサイクルは以下の通り。
PCR1: 94℃,2min→98℃,10s→64℃,30s→68℃,4min (30cycles)
PCR2: 94℃,2min→98℃,10s→68℃,4min30s (35cycles)
二回目の結果をFig.2に示す。またもそれらしいものは見当たらない。よって、サンプルの信頼性を確かめるために、LTBP3ではない別の遺伝子について同様の実験を行ってみることにした。ここではGAPDHとβ2mgについて、既存のプライマーを頂き、PCR→電気泳動を行った (Fig.3)が、失敗に終わった。この結果から、サンプルを変更することを決断、他の研究員からマウスの大動脈、血管平滑筋、肺のサンプルを頂戴し、再びPCR→電気泳動を行った (Fig.4)。念のため、LTBP3だけでなくGAPDHについても行っている。Fig.4からわかる通り、大動脈、血管平滑筋のサンプルについて漸く3.7kb付近にバンドが出現した。よりはっきりとバンドが出ている血管平滑筋のバンド部分を採取し、工程<7>以降に進んだ。PCR1,2との比較のため、サイクルを記載しておく。GAPDHについては、異なるサイクルでPCRを実施している。
PCR3: 94℃,2min→98℃,10s→72℃,4min30s (35cycles)
GAPDH: 94℃,2min→98℃,10s→60℃, 30s→68℃1min (30cycles)
制限酵素で切断後に実施した電気泳動の結果がFig.5である。No.10は明らかに切断に失敗しているが、No.1-9間に微妙な差異が確認された。残念ながらここで期間が終了してしまい、この結果の解釈はシークエンシングがなされた後に後日堀口先生からご連絡頂いた。No.1,8についてはdeletionが1箇所ずつ、No.2,5,9はinsertion1箇所ずつ、No.7はinsertion3箇所とdeletion1箇所、No.3,4はpoint mutation複数、No.6はOKとのこと。紆余曲折あったが、マウスLTBP3のクローニングに成功した。
3-4. 考察・感想
今回問題となったのは結局サンプルであり、工程<3>や<4>に不手際があったのか、そもそも摘出した臓器サンプルが不適合であったのか、原因は不明である。しかし、工程<5>,<6>で足踏みをしたおかげで、PCRへの理解が深まった。PCRの温度条件・時間条件はDNA鎖の熱変性→プライマーのアニーリング→ポリメラーゼによる相補鎖の合成という目的に合わせて決められているが、今回問題になったのはアニーリング温度である。アニーリング温度を上げると、ミスマッチが減少し、反応の特異性が高くなる、すなわち精度が上がるものの、生成されるPCR産物は少なくなる。逆にアニーリング温度を下げると、反応の特異性が減少し、PCR産物は多くなるものの、標的産物とは異なる産物が増幅される危険性も増える。そのため、通常はプライマー毎に設定されたTmでアニーリングを行うのだが、先述の通り今回用いたプライマーのTmが高過ぎたため、一回目は仕方なく相補鎖の合成温度より少々低い程度の64℃に設定し、二回目は68℃に設定した。三回目は残り日数が少なくなっていたため、68℃よりも高温にするという決断をした。最終的にこのプライマーを用いて成功しているため、恐らくは設定温度の問題ではなかったと思われるが、確証はない。
3-5. 謝辞
後述の通り、ご多忙な時期であったのにも関わらず、いろいろな研究を提案してくださり、また根気強くご指導頂きました堀口先生、並びにラボの皆様、快く機材を使わせて下さったその他のラボの皆様に厚く御礼申し上げます。
4. ニューヨークでの生活
世界の中心とも言えるニューヨークはやはり活気に溢れた街であり、様々な人種が混在し、様々な言語が飛び交っていました。中国人、韓国人を初めとするアジア系の顔が想像していたよりは多い印象でした。むしろ生粋のアメリカ人はあまりおらず、お世話になった研究室もボス以外アメリカ人ではなかったのは驚きました。レストラン等でもかなり訛が強く、英語に聞こえないような英語を話す店員が少なくなく、聞き取りに苦労する場面もしばしばありました。
両研究室には朝から夕方までお世話になり、その後や休日は観光やライブハウスで過ごしました。実際に中心地と言えるのはセントラルパーク以南であり、有名な観光名所間も徒歩で移動できるほど密集していました。移動は主に徒歩、自転車 (citiBikeというバイクシェアリングが利用できました) 、もしくは地下鉄で、バスは利用しませんでした。道は基本的に一方通行であり、細い道も多く、路上駐車も多く、日本は勿論、恐らくアメリカの他の地域の大半とは全く違う景色と言えるでしょう。
New York Universityの研究室は昨年のハリケーンサンディによる大雨で浸水し、地下で飼育していたマウスが全滅するなどの被害を被り、至るとことが工事中でした。Rifkin研は元の場所がまだサンディの所為でボロボロになったまま手つかずの状態(天井の配線はむき出しになっており、エレベーターも一基しか稼働しておらず、衝撃の光景でした)であり、場所を転々としている状態でした。機材が不足しているため、以前使っていた部屋や他の研究室で必要な機材を使わせて頂いたり、また被災まで使っていた部屋にまだ使えそうなものがないか探しに行ったりすることも頻繁にありました。

NYU Langone Medical Centerの正面玄関
5. 謝辞
医学研究の具体的なイメージをつかむことができ、また実験手技や原理への理解が深まり、最新の研究に触れることができ、将来にも関わる、大変貴重な経験をさせて頂くことができました。ご多忙であるにも関わらず我々を快く受け入れて下さいました西仁勇先生、堀口真仁先生、並びにDr. Edward Fisher, Dr. Daniel Rifkin、また本実習を斡旋して頂いた循環器内科の尾野亘先生に重ねて御礼申し上げます。

間借りしていたボロアパート(とはいえNY市内のため家賃はそこそこ)
(左)室内 (右)傾いていた階段 (左) タイムズスクエア (右)

入り浸っていた(?)ライブバー、営業時間外に撮影
NYU研修レポート 京都大学医学部医学科4回生 大谷 俊陽
私は今回のマイコースプログラムにおいて四週間にわたりNYUの研究所で研修させていただきました。最初の二週間がFisher研で西先生の下、後の二週間がRifkin研で堀口先生の下で学ばせていただきました。わたしはこの後にさらにUCSDでの研修を控えておりましたが、この研修が決まった時点ではほとんど実験については少し触れる程度にしか学んでおりませんでした。そのため私はプログラムに先立って、京大の循環器の研究所で基本的な手技や考え方、理論などを先生方に教わったり本で学びました。ですが二週間の実習では付け焼刃の感も否めず、NYUでも基礎を学ぶことが多くなってしまいました。この点に関しては深く反省し、私たちの後に続く後輩たちに対してアドバイスになればと存じます。
Fisher研においてはAtherosclerosisについて主に扱っていました。私が扱ったのはAtherosclerosisの形成におけるマクロファージの寄与についてでした。用意した大動脈の標本スライドからLaser capture microdissection(以下LCM)という機械を用いて病理部分のみを取り出すところまでを行いました。このLCMというものを循環器のこの研究分野で使用することがこの研究所の特徴であり私も体験させていただく機会がありました。LCMは、レーザー光を利用して、組織切片上の目的の細胞のみを光学顕微鏡下で1つずつ取り出す技術です。混在した組織標本から均一な細胞集団を単離できるので、その細胞に特異的な遺伝子の発現を解析できるという利点があります。私は病理細胞のみを抽出するのを体験させてもらいました。
一方で、私はその研究所でまず実験手技について基本を主に学びました。まずマウスの解剖や標本の作製を行ったり、臓器、骨を摘出してそこからmRNAを分離したりしました。また、ほかの研究者のもつマウスのサンプルからAtherosclerosisの部分を観察しました。骨髄組織からmRNAをDNAへ、そしてPCR,ウェスタンブロッティングなどの手技も学びました。
またラボのミーティングやセミナーにも参加させていただきました。セミナーでは難解な内容が英語で語られており英語力の無さと知識の少なさを痛感する結果となりました。ラボミーティングに参加させていただいたのはとても新鮮な体験でした。私は日本では二週間しか研究所に通っていなかったため、ラボミーティングには参加したことは今までありませんでした。この研究所のラボミーティングでは教授と西先生、そのパートナーの研究者の方で行われるおそらく小規模なものでした。そこで先生が、パワーポイントで発表する形で教授に実験の進捗や今後の展望についてお話しなさっており、教授はところどころで指摘しながら修正を加えていくかたちでミーティングは進みました。
二つ目に通ったRifkin研では、latent TGF-β protein(LTBP)というタンパクがTGF-βの分泌や局在などにおいて重要な役割を果たしていることに目をつけた実験を行っていました。LTBPは1~4まで存在していますが、私は大動脈において働くLTBP-3についての実験の手伝いという形で研究所で活動させていただきました。LTBPは、その発現が抑制されたときにFBN発現も抑制的になるためにマルファン症候群について関連した実験も行われていました。 私はこの研究の過程で必要となるLtbp-3をマウスからクローニングする実験の手伝ったり、飼育されている種々の遺伝子改変マウスのgenotypingも行ったりしました。こちらでは手技だけでなくプライマーの設計などの勉強もさせていただきました。実験がうまくいかないことも多かったので、7時くらいまで実験をすることもままありました。
ここの研究所にいる間に違う日本人の先生が研究なさってるものも見学できました。その研究室ではショウジョウバエを扱っていました。私自身としては、ショウジョウバエをはじめて見たのでとても貴重な体験でした。ショウジョウバエの繁殖や検体の抽出の仕方、また幼虫の解剖を見させていただきました。かなり小さいものなので顕微鏡越しの解剖でしたが、神経組織や脂肪組織などを確認することが出来ました。
またほかの研究者の研究内容を本人から聞かせてもらったり、セミナーにも出させていただきました。ここでも英語、基礎医学についての勉強不足からほんの一部しか理解できなかったことはほんとうに残念なことでした。
NYUで研修をして感じたことはたくさんありました。まず病院の設備に驚きました。とても高価な研究機器が数多くありました。そのことで先生に尋ねると海外の病院の成り立ちについても学べました。海外の病院は寄付による部分が多く、実際私がいる間にも数十億の寄付が行われていました。その規模の大きさに大変驚きました。また、研究者のスタイルにも驚きました。日本とは大きく異なり、出勤時間はばらばらで仕事終わりの時間もばらばらでした。私は遅くまでいることも少なくなかったのですが、早い人だと4時5時までにはお帰りになり、最後が私たちになることもありました。先生によりますと成果を出すことそのものが条件であり勤務スタイルは問題にはあまりならないとのことでした。日本の研究者に聞きますと朝から晩まで働くかたがほとんどだという話でしたのでこれはとても印象深かったです。
自分自身のことについていえば、英語能力、そして研究における技能、心構えというものが身についていなかったため、もっと出来たことがあったのではないかと後になって反省することがありました。ですが今回初めて医学生として海外の実情にふれたことは、これからの人生設計において大変意味のある経験になったとも実感しております。
最後になりましたが、私のためにわざわざ研究所を探してくださった尾野先生、いろいろとお世話してくださった循環器の皆様、NYUでご迷惑ばかりをおかけしてしまった西先生、堀口先生に心から感謝申し上げます。誠にありがとうございました。

