HOME > 基礎研究グループの活動 > 分子循環器グループ
分子循環器グループ
新着情報
2023年6月
尾野 亘、堀江 貴裕、宮川 紗和らの研究成果"Inhibition of microRNA-33b in humanized mice ameliorates nonalcoholic steatohepatitis."が、
2021年2月
尾野 亘、堀江 貴裕らの研究成果"microRNA-33 maintains adaptive thermogenesis via enhanced sympathetic nerve activity"が、2021年2月16日に英国科学雑誌「Nature Communications」誌に掲載されました。またこの成果は、朝日新聞(2月20日夕刊 7面)に掲載されました。当大学HPにて詳細がご覧いただけます。
2019年10月
尾野 亘、井手裕也、堀江 貴裕らの研究成果"Cardioprotective Effects of VCP Modulator KUS121 in Murine and Porcine Models of Myocardial Infarction"が、2019年10月29日にJACC : BASIC TO TRANSLATIONAL SCIENCE誌に掲載されました。京都大学発の薬剤「KUS121」が心筋梗塞サイズを縮小することを解明したとの内容です。この成果は朝日新聞(2019年10月29日 29面)、京都新聞(10月29日 27面)、毎日新聞(11月15日 22面)および読売新聞(11月3日 35面)に掲載されました。当大学HPにて詳細がご覧いただけます。
2018年7月
西野共達が第50回日本動脈硬化学会でYIA最優秀賞を受賞しました。
2018年3月
桑原康秀が第82回日本循環器学会でYIA優秀賞を受賞しました。
2014年10月
尾野 亘、桑原 康秀らの研究成果"MicroRNA-451 Exacerbates Lipotoxicity in Cardiomyocytes and High-Fat Diet-Induced Cardiac Hypertrophy in Mice through Suppression of the LKB1/AMPK Pathway"がCirculation Research誌に掲載されることになりました。
「Kuwabara Y, Horie T, Baba O, Watanabe S, Nishiga M, Usami S, Izuhara M, Nakao T, Nishino T, Otsu K, Kita T, Kimura T, Ono K. MicroRNA-451 Exacerbates Lipotoxicity in Cardiomyocytes and High-Fat Diet-Induced Cardiac Hypertrophy in Mice through Suppression of the LKB1/AMPK Pathway Circ Res. Circ Res. 2015 Jan 16;116(2):279-88.」
2014年6月
尾野 亘、堀江 貴裕、西野 共達らの研究成果"MicroRNA-33b knock-in mice for an intron of sterol regulatory element-binding factor 1 (Srebf1) exhibit reduced HDL-C in vivo"が、2014年6月16日に英国ネイチャー出版グループのオンライン雑誌「Scientific Reports」で公開されました。またこの成果は、朝日新聞(6月17日 夕刊7面)、京都新聞(6月17日 27面)、産経新聞(6月17日 26面)、日本経済新聞(6月17日 38面)および日刊工業新聞(6月17日24面)に掲載されました。当大学ホームページにて詳細がご覧頂けます。
2013年12月
尾野 亘、堀江 貴裕、西野 共達らの研究成果"MicroRNA-33 regulates sterol regulatory element-binding protein 1 expression in mice"が、2013年12月に英国科学雑誌「Nature Communications」誌のオンライン版に掲載されました。またこの成果は、朝日新聞(12月4日 6面)、京都新聞(12月8日 28面)、および日刊工業新聞(12月4日 17面)に掲載されました。当大学ホームページにて詳細がご覧頂けます。
2010年9月
尾野 亘、堀江 貴裕らの研究成果"MicroRNA-33 encoded by an intron of sterol regulatory element-binding protein 2 (Srebp2) regulates HDL in vivo"が、2010年9月に米国科学アカデミー紀要(オンライン版)に掲載されました。またこの成果は、朝日新聞(9月28日 32面)、京都新聞(9月21日 22面)、日刊工業新聞(9月21日 23面)、日本経済新聞(9月21日 30面)および読売新聞(9月21日 2面)に掲載されました。当大学ホームページにて詳細がご覧頂けます。
当研究室の概要
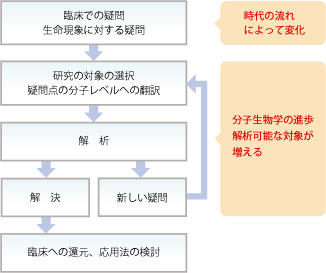
私たちは分子生物学的な手法を中心として、様々な角度から循環器疾患の分子メカニズムの解明を目指して研究を進めています。特に、疾患発症の根本原因、全身の各臓器(およびそれを構成する細胞)を結びつける共通分子基盤に着目しています。中でもゲノムの中で遺伝子以外の領域から転写されるRNA(ノンコーディングRNA)が起こす現象の解明を精力的に行っています。こうしたノンコーディングRNAの機能の解明は、思いもよらない生命現象を担っている可能性があります。さらに、循環器疾患の診断に役立つバイオマーカー探索や、心筋梗塞・心不全に対する新規治療薬の開発も行っています。
所属者

- 尾野 亘(准教授)
- 循環器内科専門医、日本内科学会専門医、医学博士、FAHA、日本動脈硬化学会動脈硬化専門医
- 中島 康弘(先制医療・生活習慣病研究センター特定講師)
- 堀江 貴裕(助教)
- 馬場 理(先制医療・生活習慣病研究センター特定講師)
- 桑原 康秀(留学中)
- 中尾 哲史(留学中)
- 西賀 雅隆(留学中)
- 西野 共達(留学中)
- 辻 修平(客員研究員)
- 大谷 千春(大学院生)
- 山﨑 智弘(大学院生)
- 渡邉 利光(大学院生)
- 徐 斯佳(大学院生)
- 松下 和揮(大学院生)
- 宮川 紗和(大学院生)
- 邹 福全(大学院生)
- 鈴木 啓太(脳神経外科 大学院生)
- 久米 英太朗(小児科 大学院生)
- 曽和 尚也(技術補佐員)
研究内容
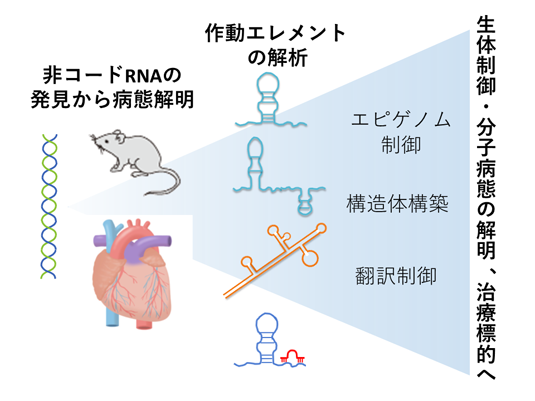
1.非コードRNAの生体における役割
1990 年代初頭までは,分子生物学のセントラルドグマ(Central Dogma)とは、設計図としてのDNA がメッセンジャーRNA に転写され,メッセンジャーRNA がポリペプチドやタンパク質に翻訳されて,遺伝情報を反映して特異的な機能が得られることとされていました。
一方,ヒトゲノム計画によりヒトゲノム30 億塩基対の中に存在するタンパク質コード遺伝子約3 万個が同定されましたが、通常の遺伝子の占める割合はヒトゲノムの約3 %にすぎないことが分かりました。それ以外の非コードDNA領域には、遺伝子の発現、DNA複製の開始、遺伝子増幅や改変を引き起こすホットスポットなどがあることが示されましたが、それ以外にも多くのRNA転写産物があることが分かってきました。これらの非コードRNA (non-coding RNA (ncRNA))は無用のものと長い間考えられていましたが、近年の一連の研究成果から,それらのncRNAが細胞や生体を制御する主要伝達経路において重要な役割を担うことが示唆されてきています(図1)。
中でも、核内の低分子RNAや20塩基程度のmicroRNA (miRNA; miR)には、発生、分化、代謝、発がんにおける機能があることが多くの研究で明らかとなっていますし、それを利用した疾患治療法も開発中です。また、数百から数千塩基対に達する「長鎖ncRNA (long non-coding RNA; lncRNA)」についての研究も最近急速に進展してきています。
(図1)
①マイクロRNA (microRNA, miR)
タンパク質を作らない、ncRNAの中でmiRNAは、特異的な標的蛋白の翻訳抑制に働いています。miRNAの数は生物の複雑さと共に増加し、ヒトゲノムには約2500個のmiRNAが存在するとみられています。
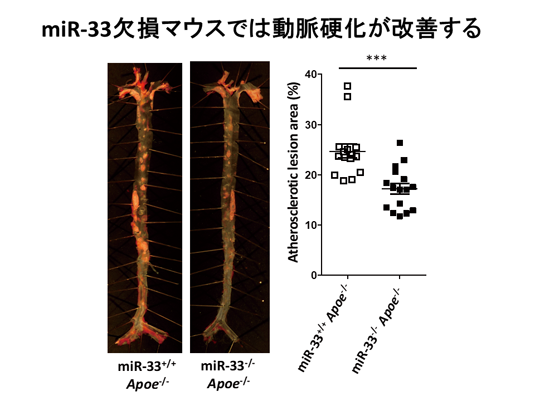
我々はSREBP-2遺伝子のイントロン16にあるmiR-33a欠損マウスを作成し、血中HDLコレステロールが著増することを見いだしました(Proc Natl Acad Sci U S A. 2010)。このマウスをApoe欠損動脈硬化モデルマウスと交配したところ、著明に動脈硬化の抑制(図2)、脂質の蓄積の低下、および炎症細胞浸潤の抑制が認められました。 (J Am Heart Assoc. 2012)。
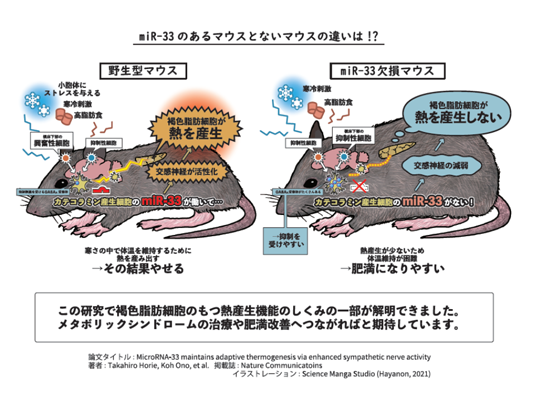
一方、げっ歯類以外の大型の哺乳類においては、SREBP-1遺伝子のイントロンにmiR-33bという同種のマイクロRNAが存在するが、これはマウスにはないため、生体でのmiR-33bの働きが解析できませんでした。我々はmiR-33bノックインマウスを作成し、これがmiR-33欠損マウスと鏡像関係にHDL-Cの低下を示すことを報告しました(Sci Rep. 2014)。さらに、miR-33a過剰発現マウス、臓器特異的miR-33欠損マウスなどの遺伝子改変マウスをすでに作成しており、ヒトサンプルやヒト疾患由来iPS細胞を用いて研究を行ってきました。特に最近では、視床下部のマイクロRNA(miRNA, miR)-33に注目し、これが寒冷刺激の際に交感神経活性化を介して、体温維持に働くことを示しました(Nature Commun. 2021)。miR-33を持たないマウス(miR-33KOマウス)を調べた結果、褐色脂肪細胞の熱産生機能が弱まり、冷たい刺激にさらされた時に体温を維持できなくなっていました。また、このマウスは、エネルギー消費が少なく肥満になりやすいこともわかりました。寒冷刺激により視床下部のmiR-33の量が増加するので、miR-33は交感神経活性の程度を変化させるスイッチとして働いて熱産生を介して、全身の代謝を調節していると考えられました(図3)。
今後も精力的にmiR-33a/bの生理的意義を解明し続けています(Nature Commun. 2021, J Am Heart Assoc. 2019, Clin Sci (Lond). 2019, Arterioscler Thromb Vasc Biol. 2018, Mol Cell Biol. 2018, Arterioscler Thromb Vasc Biol. 2017, Circ Res. 2017, Circ Res. 2015, J Neurosci. 2015, Sci Rep 2014, Nature Commun. 2013, J Am Heart Assoc. 2012, Proc Natl Acad Sci U S A. 2010, Cardiovascular Res. 2010, J Biol Chem. 2010など)。
現在、大阪大学、製薬企業との共同研究において、合成核酸によるmiR-33a/bの抑制治療に向けての研究も進行中です。
(図2)
(図3)
②心肥大・心不全に関わる長鎖非コードRNA (long ncRNA, lncRNA)
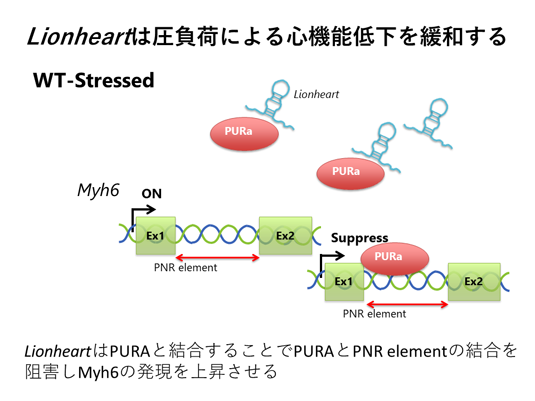
一方、200塩基以上のlncRNAにも重要な働きをするものが存在します。我々は、心肥大や心不全におけるlncRNAの機能を解明するために、心肥大、心不全心で高発現していたlong intergenic ncRNA(lincRNA)の中で、心筋と骨格筋に特異的に発現するlincRNAの欠損マウスを作成したところ、心臓のサイズが小さくなるだけでなく、負荷を与えると心不全を呈しました。一方、アデノウイルスを用いてこれを補充すると心機能が改善しました。我々はこのlincRNAをLionheartと名付け、論文発表しました(Communications Biology. 2020)(図4)。
"lionheart, BY787644" は、Mouse Genome Informatics (MGI)によりLnhrtとして登録されています。
(図4)
③動脈硬化に関わるlncRNA
細胞内コレステロールの変動にともなって発現が変化するlncRNAの機能についても遺伝子欠損マウスを作成して解析しています。
④血中・体液中miRNAの診断への応用
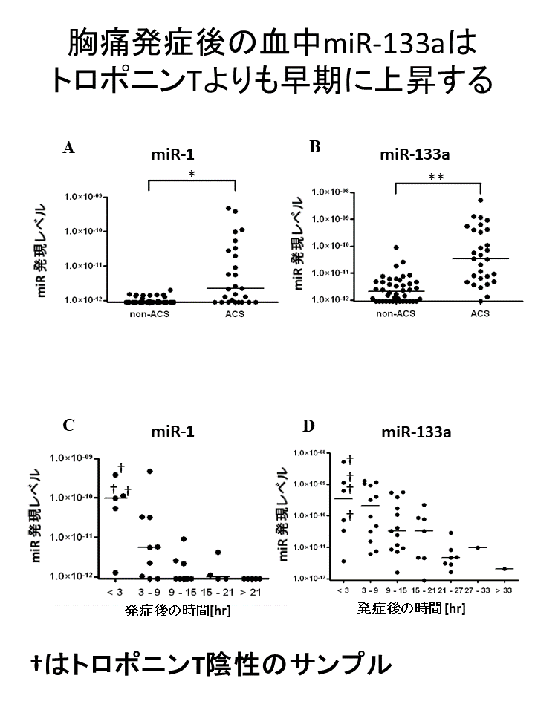
細胞の中だけでなく、血液を含む体液中にもmiRNAが脂質膜に包まれて存在しています。我々は心血管疾患の患者血清中のmiRNAについて検討しました。その結果、急性冠症候群において、胸痛発症後トロポニンTよりも早期に末梢血にmiR-133aが上昇し、これがトロポニンTレベルとよく相関することを見出しました (Circulation: Cardiovascular Genetics. 2011)(図5)。
心筋梗塞におけるmiR-133aの局在を、心筋梗塞後のマウスの心臓においてin situ hybridization法により検討したところ、miR-133aは正常心筋細胞の核周囲に存在し、心筋梗塞巣周辺領域では現象し、梗塞巣においては消失していました。このことより、心筋梗塞においては、心筋細胞中のmiR-133aが血中に流れ出しているものと考えられます。
さらに心血管疾患症例において、血中および体液中のmiRNAが診断マーカーに使えるかどうかについても検討をつづけています(PLoS One. 2015, ESC Heart Failure. 2017)。
(図5)
2.網羅的スクリーニングによる疾患関連分子の解析
心疾患の発症に関わる新たな分子を見出すことは、分子生物学的研究の醍醐味です。
①我々は代謝ストレスに暴露された時に心筋細胞から誘導される分泌蛋白、および膜型蛋白をシグナルシークエンストラップ法によって網羅的にスクリーニングし、Neural cell adhesion molecule (NCAM)というⅠ型膜蛋白を同定しました (J Mol Cell Cardiol. 2010)。さらにヒトの心筋症において、心機能の低下に伴ってNCAMの発現が上昇することも見出しました(Circulation; Heart Failure. 2014)。
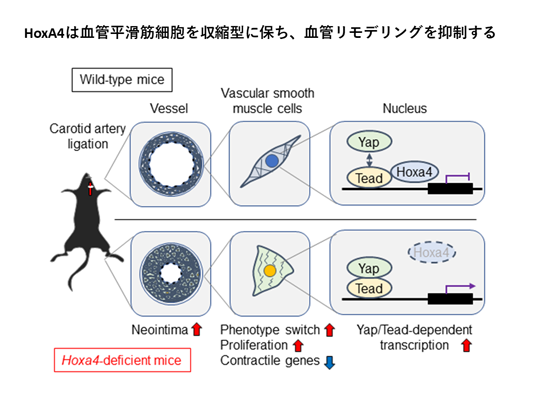
②ShRNAライブラリー(CELLECTA社 DECIPHER)を用いて、細胞増殖、形質転換に関わるHippoシグナルの調節分子を探しました。Hippoシグナル下流のTEAD活性が上昇することを指標に、網羅的なスクリーニングを行ったところ、新規のTEADの抑制因子としてHoxA4を見出し、論文発表しました(EMBO Reports. 2020)(図6)。このHoxA4欠損マウスでは血管平滑筋が増殖型に形質転換し、動脈硬化を生じやすくなることを見出しました。
現在HoxA4の分子機能を応用した治療法開発研究を行っています。
(図6)
3.臓器を構成する細胞間コミュニケーションの解析
疾患は遺伝子の発現変化のみによって生じるわけではありません。細胞間や臓器間の関連性も大変重要な解析対象と考えています。
①脂肪組織においては、ペリオスチンというマトリセルラータンパクが肥満の際に著明に増加して、マクロファージを呼び寄せて脂肪組織の炎症を惹起するとともに、脂肪組織の線維化、さらにはインスリン抵抗性に関わることを明らかにしました(Sci Rep. 2018)。
②また、特定の細胞に細胞死を誘導することのできるマウスを用いて、心臓を構成する細胞同士の関係を解析しています。今後、この手法を用いて、心不全が発症する際のキープレーヤーが明らかになると考えています。
4.心筋梗塞・心不全治療薬の開発
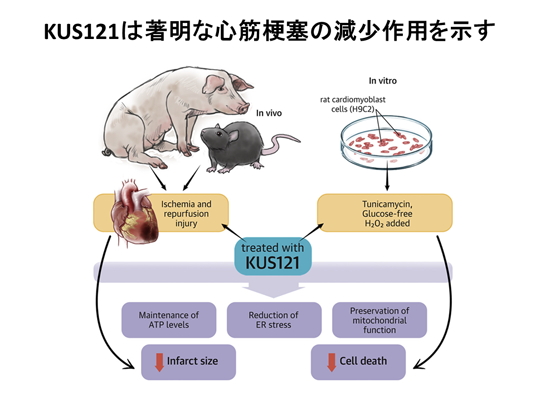
現在、わが国の疾患別死因の中で、心疾患は15.2%を占め、悪性新生物に続いて第2番目となっています。その中でも虚血性心疾患への対策はまだ不十分で、心筋梗塞早期の血流再開(再灌流療法)は可能であるが、再灌流に伴って起こる心筋障害(再灌流障害)に対する治療法は皆無です。京都大学生命科学研究科の垣塚先生らにより開発されたVCPのATPaseの阻害剤(KUS剤:Kyoto University Substance)は、細胞内のATP減少と小胞体ストレスを軽減し、細胞死を抑制する作用があります。我々の検討により、KUS剤がブタ心筋梗塞モデルにおいて著明な心筋梗塞の減少作用を示すことが明らかになりました(JACC Basic Transl Sci. 2019)(図7)。用途特許を申請済みで、治験に向けた準備を行っています。さらに幅広い適応を検討中です。
(図7)
5.新規シーケンサーによるゲノムの解析
我が国における家族性高脂血症(Familial hypercholesterolemia; FH)患者総数は、25万人以上と推定されます。様々な遺伝性代謝疾患の中でもFHは最も頻度が高く、日常診療においてよく遭遇する疾患といえます。LDLRやPCSK9遺伝子の異常によって、LDL-Cが上昇して動脈硬化性疾患を発症するのですが、冠動脈疾患は、ホモあるいはヘテロのFHで早期に発症することが多く、若いころからの治療開始が望まれます。しかしながら、その診断率は非常に低く、日本では1%以下と考えられています。また、FHの59%の患者さんしか脂質低下療法を受けていないとの報告もあります。
こうした低い診断率の原因の一つは、遺伝子診断が実行されていないためと考えられます。そこで、一度に長い塩基の配列を解析できるNanopore sequencerを用いて、FHの遺伝子変異の解析を簡便にできるように工夫しています。エクソンのみならず、非コード領域を含めた遺伝子変異の解析も行っています。
主な発表論文
- Horie T, Nakao T, Miyasaka Y, Nishino T, Matsumura S, Nakazeki F, Ide Y, Kimura M, Tsuji S, Ruiz Rodriguez R, WatanabeT, Yamasaki T, Xu S, Otani C, Miyagawa S, Matsushita K, Sowa N, Omori A, Tanaka J, Nishimura C, Nishiga M, Kuwabara Y, Baba O, Watanabe S, Nishi H, NakashimaY, Picciotto MR, Inoue H, Watanabe D, Nakamura K, Sasaki T, Kimura T, Ono K. MicroRNA-33 maintains adaptive thermogenesis via enhanced sympathetic nerve activity. Nature Communicatoins 2021 Feb 16;12(1):843.
- Ono K, Horie T, Baba O, Kimura M, Tsuji S, Ruiz Rodriguez R, Sawa M, Kimura T. Functional Non-coding RNAs in Vascular Diseases. FEBS Lett. 2020 Dec 19. Online ahead of print.
- Kuwabara Y, Tsuji S, Nishiga M, Izuhara M, Ito S, Nagao K, Horie T, Watanabe S, Koyama S, Kiryu H, Nakashima Y, Baba O, Nakao T, Nishino T, Sowa N, Miyasaka Y, Hatani T, Ide Y, Nakazeki F, Kimura M, Yoshida Y, Inada T, Kimura T, Ono K. Lionheart LincRNA alleviates cardiac systolic dysfunction under pressure overload. Commun Biol. 2020 Aug 13;3(1):434.
- Kimura M, Horie T, Baba O, Ide Y, Tsuji S, Ruiz Rodriguez R, Watanabe T, Yamasaki T, Otani C, Xu S, Miyasaka Y, Nakashima Y, Kimura T, Ono K. Homeobox A4 suppresses vascular remodeling by repressing YAP/TEAD transcriptional activity. EMBO Rep. 2020 Mar 9:e48389.
- Ono K, Wada H, Asahara N, Inoue H, Uehara K, Funada J, Ogo A, Horie T, Fujita M, Shimatsu A, Hasegawa K, on behalf of the ABLE-MET Investigators. Effects of metformin on left ventricular size and function in hypertensive patients with type 2 diabetes mellitus: results of a randomized, controlled, multicentre, Phase IV trial. American J of Cardiovasc Drugs 2020 Jun;20(3):283-293.
- Ide Y, Horie T, Saito N, Watanabe S, Otani C, Miyasaka Y, Kuwabara Y, Nishino T, Nakao T, Nishiga M, Nishi H, Nakashima Y, Nakazeki F, Koyama S, Kimura M, Tsuji S, Rodriguez RR, Xu S, Yamasaki T, Watanabe T, Yamamoto M, Yanagita M, Kimura T, Kakizuka A, Ono K. Cardioprotective Effects of VCP Modulator KUS121 in Murine and Porcine Models of Myocardial Infarction. JACC Basic Transl Sci. 2019 Oct 28;4(6):701-714.
- Koyama S, Horie T, Nishino T, Baba O, Sowa N, Miyasaka Y, Kuwabara Y, Nakao T, Nishiga M, Nishi H, Nakashima Y, Nakazeki F, Ide Y, Kimura M, Tsuji S, Rodriguez RR, Xu S, Yamasaki T, Otani C, Watanabe T, Nakamura T, Hasegawa K, Kimura T, Ono K. The identification of differential roles of microRNA-33a and -33b during atherosclerosis progression with genetically modified mice. J Am Heart Assoc 2019 Jul 2;8(13):e012609.
- Nakazeki F, Tsuge I, Horie T, Imamura K, Tsukita K, Hotta A, Baba O, Kuwabara Y, Nishino T, Nakao T, Nishiga M, Nishi H, Nakashima Y, Ide Y, Koyama S, Kimura M, Tsuji S, Naitoh M, Suzuki S, Izumi Y, Kawarai T, Kaji R, Kimura T, Inoue H, Ono K. MiR-33a is a therapeutic target in SPG4-related hereditary spastic paraplegia human neurons. Clin Sci (Lond). 2019 Feb 22;133(4):583-595.
- Hakuno D, Kimura M, Ito S, Satoh J, Nakashima Y, Horie T, Kuwabara Y, Nishiga M, Ide Y, Baba O, Nishi H, Nakao T, Nishino T, Nakazeki F, Koyama S, Hanada R, Randolph RR, Endo J, Kimura T, Ono K. Hepatokine α1-Microglobulin Signaling Exacerbates Inflammation and Disturbs Fibrotic Repair in Mouse Myocardial Infarction. Sci Rep. 2018 Nov 13;8(1):16749.
- Nishino T, Horie T, Baba O, Sowa N, Hanada R, Kuwabara Y, Nakao T, Nishiga M, Nishi H, Nakashima Y, Nakazeki F, Ide Y, Koyama S, Kimura M, Nagata M, Yoshida K, Takagi Y, Nakamura T, Hasegawa K, Miyamoto S, Kimura T, Ono K. SREBF1/MicroRNA-33b Axis Exhibits Potent Effect on Unstable Atherosclerotic Plaque Formation In Vivo. Arterioscler Thromb Vasc Biol. 2018 Oct;38(10):2460-2473.
- Nakazeki F, Nishiga M, Horie T, Nishi H, Nakashima Y, Baba O, Kuwabara Y, Nishino T, Nakao T, Ide Y, Koyama S, Kimura M, Tsuji S, Sowa N, Yoshida S, Conway SJ, Yanagita M, Kimura T, Ono K. Loss of periostin ameliorates adipose tissue inflammation and fibrosis in vivo. Sci Rep. 2018 Jun 4;8(1):8553.
- Baba O, Horie T, Nakao T, Hakuno D, Nakashima Y, Nishi H, Kuwabara Y, Nishiga M, Nishino T, Ide Y, Nakazeki F, Koyama S, Kimura M, Hanada R, Kawahara M, Kimura T, Ono K. MicroRNA 33 Regulates the Population of Peripheral Inflammatory Ly6C(high) Monocytes through Dual Pathways. Mol Cell Biol. 2018 Jun 28;38(14). pii: e00604-17.
- Ono K, Kuwabara Y, Horie T, Kimura T. Long Non-Coding RNAs as Key Regulators of Cardiovascular Diseases. Circ J. 2018 Apr 25;82(5):1231-1236.
- Nakao T, Horie T, Baba O, Nishiga M, Nishino T, Izuhara M, Kuwabara Y, Nishi H, Usami S, Nakazeki F, Ide Y, Koyama S, Kimura M, Sowa N, Ohno S, Aoki H, Hasegawa K, Sakamoto K, Minatoya K, Kimura T, Ono K. Genetic Ablation of MicroRNA-33 Attenuates Inflammation and Abdominal Aortic Aneurysm Formation via Several Anti-Inflammatory Pathways. Arterioscler Thromb Vasc Biol. 2017 Nov;37(11):2161-2170.
- Koyama S, Kuragaichi T, Sato Y, Kuwabara Y, Usami S, Horie T, Baba O, Hakuno D, Nakashima Y, Nishino T, Nishiga M, Nakao T, Arai H, Kimura T, Ono K. Dynamic changes of serum microRNA-122-5p through therapeutic courses indicates amelioration of acute liver injury accompanied by acute cardiac decompensation. ESC Heart Fail. 2017 May;4(2):112-121.
- Izuhara M, Kuwabara Y, Saito N, Yamamoto E, Hakuno D, Nakashima Y, Horie T, Baba O, Nishiga M, Nakao T, Nishino T, Nakazeki F, Ide Y, Kimura M, Kimura T, Ono K. Prevention of neointimal formation using miRNA-126-containing nanoparticle-conjugated stents in a rabbit model. PLoS One. 2017 Mar 2;12(3):e0172798.
- Nishiga M, Horie T, Kuwabara Y, Nagao K, Baba O, Nakao T, Nishino T, Hakuno D, Nakashima Y, Nishi H, Nakazeki F, Ide Y, Koyama S, Kimura M, Hanada R, Nakamura T, Inada T, Hasegawa K, Conway SJ, Kita T, Kimura T, Ono K. MicroRNA-33 Controls Adaptive Fibrotic Response in the Remodeling Heart by Preserving Lipid Raft Cholesterol. Circ Res. 2017 Mar 3;120(5):835-847.
- Ono K. A Novel Link between Plasma MicroRNA-33b Levels and Lipid Disorders in Diabetes Mellitus. J Atheroscler Thromb. 2016 Nov 1;23(11):1259-1260.
- Ono K. microRNAs and Cardiovascular Remodeling. Adv Exp Med Biol. 2015;888:197-213.
- Ono K. Functions of microRNA-33a/b and microRNA therapeutics. J Cardiol. 2016 Jan;67(1):28-33.
- Horie T, Kimura T, Ono K. Emerging Novel Biomarkers for Arteriosclerosis Obliterans. J Atheroscler Thromb. 2016;23(2):171-2.
- Miyamoto S, Usami S, Kuwabara Y, Horie T, Baba O, Hakuno D, Nakashima Y, Nishiga M, Izuhara M, Nakao T, Nishino T, Ide Y, Nakazeki F, Wang J, Ueyama K, Kimura T, Ono K. Expression Patterns of miRNA-423-5p in the Serum and Pericardial Fluid in Patients Undergoing Cardiac Surgery. PLoS One. 2015 Nov 12;10(11):e0142904.
- Ono K, Horie T, Nishino T, Baba O, Kuwabara Y, Kimura T. MicroRNAs and High-Density Lipoprotein Cholesterol Metabolism. Int Heart J. 2015;56(4):365-71.
- Izuhara M, Ono K, Shiomi H, Morimoto T, Furukawa Y, Nakagawa Y, Shizuta S, Tada T, Tazaki J, Horie T, Kuwabara Y, Baba O, Nishino T, Kita T, Kimura T; CREDO-Kyoto PCI/CABG Registry Cohort-2 Investigators. High-density lipoprotein cholesterol levels and cardiovascular outcomes in Japanese patients after percutaneous coronary intervention: a report from the CREDO-Kyoto registry cohort-2. Atherosclerosis. 2015 Oct;242(2):632-8.
- Ono K, Horie T, Nishino T, Baba O, Kuwabara Y, Yokode M, Kita T, Kimura T. MicroRNA-33a/b in lipid metabolism - novel "thrifty" models. Circ J. 2015;79(2):278-84.
- Ono K. MicroRNA-133a in the Development of Arteriosclerosis Obliterans. J Atheroscler Thromb. 2015;22(4):342-3.
- Kuwabara Y, Horie T, Baba O, Watanabe S, Nishiga M, Usami S, Izuhara M, Nakao T, Nishino T, Otsu K, Kita T, Kimura T, Ono K. MicroRNA-451 exacerbates lipotoxicity in cardiac myocytes and high-fat diet-induced cardiac hypertrophy in mice through suppression of the LKB1/AMPK pathway. Circ Res. 2015 Jan 16;116(2):279-88.
- Watanabe S, Horie T, Nagao K, Kuwabara Y, Baba O, Nishi H, Sowa N, Narazaki M, Matsuda T, Takemura G, Wada H, Hasegawa K, Kimura T, Ono K. Cardiac-specific inhibition of kinase activity in calcium/calmodulin-dependent protein kinase kinase-β leads to accelerated left ventricular remodeling and heart failure after transverse aortic constriction in mice. PLoS One. 2014 Sep 25;9(9):e108201.
- Horie T, Nishino T, Baba O, Kuwabara Y, Nakao T, Nishiga M, Usami S, Izuhara M, Nakazeki F, Ide Y, Koyama S, Sowa N, Yahagi N, Shimano H, Nakamura T, Hasegawa K, Kume N, Yokode M, Kita T, Kimura T, Ono K. MicroRNA-33b knock-in mice for an intron of sterol regulatory element-binding factor 1 (Srebf1) exhibit reduced HDL-C in vivo. Sci Rep. 2014 Jun 16;4:5312.
- Nagao K, Sowa N, Inoue K, Tokunaga M, Fukuchi K, Uchiyama K, Ito H, Hayashi F, Makita T, Inada T, Tanaka M, Kimura T, Ono K. Myocardial expression level of neural cell adhesion molecule correlates with reduced left ventricular function in human cardiomyopathy. Circ Heart Fail. 2014 Mar 1;7(2):351-8.
- Ono K. Seeing is believing - Imaging of a plaque in the renal artery. J Cardiol Cases. 2013 Dec 13;9(2):84-85.
- Horie T, Nishino T, Baba O, Kuwabara Y, Nakao T, Nishiga M, Usami S, Izuhara M, Sowa N, Yahagi N, Shimano H, Matsumura S, Inoue K, Marusawa H, Nakamura T, Hasegawa K, Kume N, Yokode M, Kita T, Kimura T, Ono K. MicroRNA-33 regulates sterol regulatory element-binding protein 1 expression in mice. Nat Commun. 2013;4:2883.
- Horie T, Baba O, Kuwabara Y, Yokode M, Kita T, Kimura T, Ono K. MicroRNAs and Lipoprotein Metabolism. J Atheroscler Thromb. 2014;21(1):17-22.
- Horie T, Baba O, Kuwabara Y, Chujo Y, Watanabe S, Kinoshita M, Horiguchi M, Nakamura T, Chonabayashi K, Hishizawa M, Hasegawa K, Kume N, Yokode M, Kita T, Kimura T, Ono K. MicroRNA-33 deficiency reduces the progression of atherosclerotic plaque in ApoE-/- mice. J Am Heart Assoc. 2012 Dec;1(6):e003376.
- Ono K. Current concept of reverse cholesterol transport and novel strategy for atheroprotection. J Cardiol. 2012 Nov;60(5):339-43.
- Sowa N, Horie T, Kuwabara Y, Baba O, Watanabe S, Nishi H, Kinoshita M, Takanabe-Mori R, Wada H, Shimatsu A, Hasegawa K, Kimura T, Ono K. MicroRNA 26b encoded by the intron of small CTD phosphatase (SCP) 1 has an antagonistic effect on its host gene. J Cell Biochem. 2012 Nov;113(11):3455-65.
- Kuwabara Y, Ono K, Horie T, Nishi H, Nagao K, Kinoshita M, Watanabe S, Baba O, Kojima Y, Shizuta S, Imai M, Tamura T, Kita T, Kimura T. Increased microRNA-1 and microRNA-133a levels in serum of patients with cardiovascular disease indicate myocardial damage. Circ Cardiovasc Genet. 2011 Aug 1;4(4):446-54.
- Ono K. MicroRNA links obesity and impaired glucose metabolism. Cell Res. 2011 Jun;21(6):864-6.
- Ono K, Kuwabara Y, Han J. MicroRNAs and cardiovascular diseases. FEBS J. 2011 May;278(10):1619-33.
- Nishi H, Ono K, Horie T, Nagao K, Kinoshita M, Kuwabara Y, Watanabe S, Takaya T, Tamaki Y, Takanabe-Mori R, Wada H, Hasegawa K, Iwanaga Y, Kawamura T, Kita T, Kimura T. MicroRNA-27a regulates beta cardiac myosin heavy chain gene expression by targeting thyroid hormone receptor beta1 in neonatal rat ventricular myocytes. Mol Cell Biol. 2011 Feb;31(4):744-55.
- Ono K, Wang X, Kim SO, Armstrong LC, Bornstein P, Han J. Metaxin deficiency alters mitochondrial membrane permeability and leads to resistance to TNF-induced cell killing. Protein Cell. 2010 Feb;1(2):161-73. doi: 10.1007/s13238-010-0017-y. Erratum in: Protein Cell. 2010 Dec;1(12):1128.
- Horie T, Ono K, Horiguchi M, Nishi H, Nakamura T, Nagao K, Kinoshita M, Kuwabara Y, Marusawa H, Iwanaga Y, Hasegawa K, Yokode M, Kimura T, Kita T. MicroRNA-33 encoded by an intron of sterol regulatory element-binding protein 2 (Srebp2) regulates HDL in vivo. Proc Natl Acad Sci U S A. 2010 Oct 5;107(40):17321-6.
- Watanabe S, Tamura T, Ono K, Horiuchi H, Kimura T, Kita T, Furukawa Y. Insulin-like growth factor axis (insulin-like growth factor-I/insulin-like growth factor-binding protein-3) as a prognostic predictor of heart failure: association with adiponectin. Eur J Heart Failure. 2010;12:1214-22.
- Kinoshita M, Ono K, Horie T, Nagao K, Nishi H, Kuwabara Y, Takanabe-Mori R, Hasegawa K, Kita T, and Kimura T. Regulation of adipocyte differentiation by activation of serotonin (5-HT) receptors 5-HT2AR and 5-HT2CR and involvement of microRNA-448-mediated repression of KLF5. Molecular Endoclinology. 2010;24:1978-87.
- Takanabe-Mori R, Ono K, Sowa N, Takaya T, Horie T, Satoh-Asahara N, Shimatsu A, Fujita M, Sawamura T, Hasegawa K. LOX-1 is required for the adipose tissue expression of proinflammatory cytokines in high-fat diet-induced obese mice. Biochem Biophys Res Commun. 2010;398:576-80.
- Kaichi S, Hasegawa K, Takaya T, Yokoo N, Mima T, Kawamura T, Morimoto T, Ono K, Baba S, Doi H, Yamanaka S, Nakahata T, Heike T. Cell line-dependent differentiation of induced pluripotent stem cells into cardiomyocytes in mice. Cardiovasc Res. 2010;88:314-23.
- Horie T, Ono K, Nishi H, Nagao K, Kinoshita M, Watanabe S, Kuwabara Y, Nakashima Y, Takanabe-Mori R, Nishi E, Hasegawa K, Kita T, Kimura T. Acute Doxorubicin Cardiotoxicity Is Associated with miR-146a-induced Inhibition of the Neuregulin-ErbB Pathway Cardiovascular Res. 2010;87:656-664.
- Nishi H, Ono K, Iwanaga Y, Horie T, Nagao K, Takemura G, Kinoshita M, Kuwabara Y, Takanabe Mori R, Hasegawa K, Kita T, Kimura T. MicroRNA-15b modulates cellular ATP levels and degenerates mitochondria via ARL2 in neonatal rat cardiac myocytes. J Biol Chem. 2010;285:4920-30.
- Nagao K, Ono K, Iwanaga Y, Tamaki Y, Kojima Y, Horie T, Nishi H, Kinoshita M, Kuwabara Y, Hasegawa K, Kita T, Kimura T. Neural cell adhesion molecule is a cardioprotective factor up-regulated by metabolic stress. Journal of Molecular and Cellular Cardiology. 2010;48:1157-68.
- Ono K, Wang X, Kim SO, Armstrong LC, Bornstein P, Han J. Metaxin deficiency alters mitochondrial membrane permeability and leads to resistance to TNF-induced cell killing. Protein Cell. 2010;1:161-173.
- Nakashima Y, Ono K, Yoshida Y, Kojima Y, Kita T, Tanaka M, Kimura T. The search for Nkx2-5-regulated genes using purified embryonic stem cell-derived cardiomyocytes with Nkx2-5 gene targeting. Biochem Biophys Res Commun. 2009;390:821-6.
- Horie T, Ono K, Nishi H, Iwanaga Y, Nagao K, Kinoshita M, Kuwabara Y, Takanabe R, Hasegawa K, Kita T, Kimura T. MicroRNA-133 regulates the expression of GLUT4 by targeting KLF15 and is involved in metabolic control in cardiac myocytes. Biochem Biophys Res Commun. 2009;389:315-20.
- Takaya T, Ono K, Kawamura T, Takanabe R, Kaichi S, Morimoto T, Wada H, Kita T, Shimatsu A, Hasegawa K. MicroRNA-1 and MicroRNA-133 in Spontaneous Myocardial Differentiation of Mouse Embryonic Stem Cells. Circulation J. 2009;73:1492-7.
- Kojima Y, Ono K, Inoue K, Takagi Y, Kikuta K-I, Nishimura M, Yoshida Y, Nakashima Y, Matsumae H, Furukawa Y, Mikuni N, Nobuyoshi M, Kimura T, Kita T, Tanaka M. Progranulin Expression in Advanced Human Atherosclerotic Plaque. Atherosclerosis. 2009;206:102-108.
- Takanabe R, Ono K, Abe Y, Takaya T, Horie T, Wada H, Kita T, Satoh N, Shimatsu A, Hasegawa K. Up-regulated expression of microRNA-143 in association with obesity in adipose tissue of mice fed high-fat diet. Biochem Biophys Res Commun. 2008;376:728-32.
- Matsumae H, Yoshida Y, Ono K, Togi K, Inoue K, Furukawa Y, Nakashima Y, Kojima Y, Nobuyoshi M, Kita T, Tanaka M. Inhibition of CCN1 suppressed neointimal hyperplasia in a rat balloon injury model. Arterioscler Thromb Vasc Biol. 2008;28:1077-83.
- Horie T, Ono K, Kinoshita M, Nishi H, Nagao K, Kawamura T, Abe Y, Wada H, Shimatsu A, Kita T, Hasegawa K. TG-interacting factor is required for the differentiation of preadipocytes. J Lipid Res. 2008;49:1224-34.
- Horie T, Ono K, Nagao K, Nishi H, Kinoshita M, Kawamura T, Wada H, Shimatsu A, Kita T, Hasegawa K. Oxidative stress induces GLUT4 translocation by activation of PI3-K/Akt and dual AMPK kinase in cardiac myocytes. J Cell Physiol. 2008;215:733-42.
- Abe Y, Ono K, Kawamura T, Wada H, Kita T, Shimatsu A, Hasegawa K. Leptin induces elongation of cardiac myocyte and causes eccentric left ventricular dilatation with compensation. Am J Physiol Heart Circ Physiol. 2007;292:H2387-96.
受賞歴
尾野 亘
第19回日本臨床分子医学会『学会賞』(2016年)
第46回日本動脈硬化学会『五島雄一郎賞』(2014年)
第2回日本心不全学会学術集会 YIA最優秀賞(1998年)
第45回日本心臓病学会学術集会 YIA(1997年)
堀江 貴裕
ISHR日本部会Travel Award(ISHR World Congress 2019)(2019年)
第23回日本血管生物医学会学術集会(CVMW2015)『Young Investigator's Awards 優秀賞 』(2015年)
第47回日本動脈硬化学会『優秀ポスター賞』(2015年)
第一回国際心血管薬物治療法学会日本部会学術集会『研究奨励最優秀賞(基礎部門)』(2015年)
公益財団法人宇部興産学術振興財団『学術奨励賞』(2015年)
9th Metabolic Syndrome, Type 2 Diabetes and Atherosclerosis Congress 『Poster Award』(2014年)
公益財団法人 成人血管病研究振興財団『平成26年度岡本研究奨励賞』(2014年)
第51回日本臨床分子医学会『学術奨励賞』(2014年)
第八回高血圧と冠動脈疾患研究会『最優秀研究賞』(2013年)
第45回日本動脈硬化学会『第21回若手研究者奨励賞 最優秀賞』(2013年)
国際心血管薬物療法学会日本部会(J-ISCP)『若手研究奨励賞』(2013年)
第44回日本動脈硬化学会『優秀ポスター賞』(2012年)
3rd Molecular Cardiovascular Conference Ⅱ『ポスターアワード優秀賞』(2012年)
第20回日本血管生物医学会学術集会[併催]第10回Korea-Japan Joint Symposium on Vascular Biology『Best Award of Oral Session』(2012年)
公益財団法人 万有生命科学振興国際交流財団『第1回万有医学奨励賞優秀賞』(2012年)
第75回日本循環器学会 『Young Investigator's Award 優秀賞』 (2011年)
長央 和也
第34回心筋生検研究会『Young Investigator's Award』(2012年)
第10回京都心血管疾患フォーラム『研究部門最優秀賞』(2012年)
桑原 康秀
第52回 日本臨床分子医学会 『学術奨励賞(YIA)』 (2015年)
第九回 高血圧と冠動脈疾患研究会 研究賞 (2014年)
9th Metabolic Syndrome, Type 2 Diabetes and Atherosclerosis Congress 『Poster Award』(2014年)
第82回日本循環器学会『YIA優秀賞』(2018年)
馬場 理
第12回日本心臓財団・アステラス「動脈硬化Update」奨励研究 (2014年)
西野 共達
第13回日本心臓財団・アステラス「動脈硬化Update」奨励研究(2015年)
第50回日本動脈硬化学会『YIA最優秀賞』(2018年)
西賀 雅隆
第20回日本心血管内分泌代謝学会『若手研究奨励賞』(2016年)
第39回日本分子生物学会年会『優秀ポスター賞』(2016年)
第20回日本心不全学会学術集会『YIA審査講演(基礎)優秀賞』(2016年)
木村 昌弘
2019 Paul Dudley White International Scholar at the Basic Cardiovascular Science Scientific Sessions 2019(2019年)
CVMW2019 Best Presentation Award(2019年)
ISHR日本部会Travel Award(ISHR World Congress 2019)(2019年)
辻 修平
第3回日本循環器学会基礎研究フォーラム ベストポスターアワード(2019年)
留学助成
中尾 哲史
上原財団海外留学助成リサーチフェローシップ(2018年)
西賀 雅隆
日本学術振興会海外特別研究員(2017年)
桑原 康秀
MSD生命科学財団海外留学助成(2016年)
馬場 理
公益財団法人 万有生命科学振興国際交流財団 2015年度海外留学助成(2016年)
西 仁勇
第24回日本心臓財団・バイエル薬品海外留学助成(2011年)
小島 洋児
公益財団法人鈴木万平糖尿病財団 平成22年度海外留学助成(2010年)
特許権等知的財産権の取得及び申請状況
- 京大整理番号:6592
発明の名称:microRNA(miR)-33aおよびmiR-33bを個別に制御できる合成核酸医薬の開発と大動脈瘤に対する効果
出願人:京都大学/大阪大学/国立研究開発法人医薬基盤・健康・栄養研究所/田辺三菱製薬 尾野 亘、堀江貴裕、西野共達、山崎智弘 - 京大整理番号:6046
発明の名称:心筋細胞の保護用の医薬組成物
発明者:垣塚彰、尾野 亘、堀江貴裕、井手裕也、斉藤成達、木村剛
国際出願番号:PCT/JP2019/016083
国際出願日:2019/04/15
出願人:(国)京都大学 - 京大整理番号:6185
発明の名称:遺伝性痙性対麻痺(Hereditary Spastic Paraplegia; HSP)SPG4に対するmicroRNA-33a抑制療法
発明者:井上治久、尾野亘、今村 恵子、堀江貴裕、中関 典子
出願番号:特願2018-119251
出願日:平成30年(2018年)6月22日 - 発明の名称:TDP-43プロテノパシーの予防又は治療用組成物(当研究所整理番号4996)
発明者:井上治久、津下到、尾野亘、鈴木茂彦、内藤素子
特許出願日(日本):2015年10月7日
基礎出願番号:特願2015-199526
米国出願番号:15/370,032 - 発明の名称:マイクロRNA溶出型ステント及びそれを用いた管腔治療
出願番号:PCT/JP2015/056749
出願日:2015/03/06 尾野 亘、斉藤成達、出原正康、木村 剛
メンバー募集
分子循環器グループでは、熱意を持って一緒に研究してくれるスタッフ(医員、大学院生、学生等)を募集しています。
連絡は尾野 亘までE-mailでお願いします。
- e-mail: kohono*kuhp.kyoto-u.ac.jp
(上記*を@に変えてお送り下さい。e-mailの場合、タイトルは、「分子循環器グループ スタッフ募集について」と記載してください。尚、京都大学医学部附属病院のサーバーシステムの事情により、メール受信がブロックされる場合があります。)

